Ovotestis
Un ovotestis (de ovum, œuf, et testiculus, testicule) est une gonade ayant à la fois les caractéristiques d'un testicule et d'un ovaire[1],[2],[3].
Chez l'être humain, les ovotestis sont une variation anatomique peu fréquente associée à la dysgénésie gonadique, qui est une forme d'intersexuation[4],[5].
Chez les invertébrés qui sont naturellement hermaphrodites, tels que certains gastéropodes, l'ovotestis est un organe commun de l'anatomie reproductive.
Chez l'être humain modifier
Chez l'être humain, la présence d'ovotestis est un cas d'intersexuation causée par une variation du développement sexuel appelée dysgénésie gonadique[4],[5] :
- Chimérisme ou mosaïcisme, généralement de formule chromosomique 46,XX/46,XY[6] ou, moins souvent, 46,XY/47,XXY[7] ;
- Chez des personnes ayant des chromosomes 46,XX[8] ou 46,XY, il peut être dû à un fonctionnement inhabituel ou à une mutation du gène SRY, responsable de la différenciation sexuelle chez le fœtus[4] ;
- Plus rarement, d'autres variations chromosomiques : 47,XXY, 47,XYY, 45,XO, 46, X del X[9].
L'ovotestis est la gonade la plus fréquemment observées dans les cas d'« hermaphrodisme vrai ». L'observation d'un ovotestis ne permet pas de présumer de la nature de l'autre gonade. Il est composé de tissus testiculaires et de tissus ovariens, dans des proportions variant d'un extrême à l'autre, et nettement séparés[9].
Il peut être trouvé en position ovarienne, dans le pli labioscrotal ou dans l'anneau inguinal interne. Sa position est corrélée avec sa teneur en tissus testiculaires : plus il y a de tissus testiculaires, plus il est susceptible de se trouver en position basse.
Dans l'ovotestis, l'apparence des tissus ovariens est normale dans les 3/4 des cas, l'anomalie principale étant une réduction du nombre de follicules primordiaux chez l'enfant. Dans un cas sur deux, l'ovotestis montre des signes d'ovulation. En comparaison, les tissus testiculaires de l'ovotestis sont généralement anormaux. la spermatogonie et la Spermatogenèse n'y ont jamais été observés[9].
Face aux cas d'enfants intersexes, plusieurs opinions existent quant au comportement adéquat à adopter. L'usage médical consiste généralement à mettre en place un traitement hormonal et des opérations pour faire correspondre l'enfant à un sexe défini, masculin ou féminin[10], tandis que les associations de personnes intersexes arguent que ces opérations sont des atteintes à l'intégrité physique des enfants, qui sont médicalement inutiles et occasionnent des traumatismes[11].
Recherche génétique modifier
Diverses expériences ont été menées chez la souris autour du gène Sox9, qui est déclenché par le gène-architecte SRY du chromosome Y[12],[13]. Les ovotestis chez la souris sont structurées de telle manière que le centre est un tissu testiculaire, tandis que les pôles sont constitués de tissu ovarien.
Chez les gastéropodes modifier
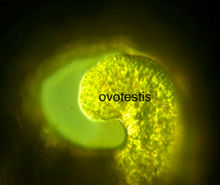
L'ovotestis, ou glande hermaphroditique (latin : glandula hermaphroditica)[14], est un organe commun du système reproducteur de certains gastéropodes, notamment chez des espèces telles que l'escargot de terre Helix aspersa[15].
Voir aussi modifier
Liens externes modifier
Notes et références modifier
- (en) « eMedicine - Ovotestis : Article par Gail F Whitman-Elia, MD » (consulté le )
- « ovo-testes (formerly called "true hermaphroditism") », sur Intersex Society of North America (consulté le )
- Éditions Larousse, « Définitions : ovotestis - Dictionnaire de français Larousse », sur www.larousse.fr (consulté le )
- Salas-Cortés L, Jaubert F, Nihoul-Feketé C, Brauner R, Rosemblatt M, Fellous M, « SRY protein is expressed in ovotestis and streak gonads from human sex-reversal », Cytogenet. Cell Genet., vol. 91, nos 1–4, , p. 212–6 (PMID 11173859, DOI 10.1159/000056847, lire en ligne)
- CISMeF, « CISMeF », sur www.chu-rouen.fr (consulté le )
- (en) Ovulation in a cytogenetically proved phenotypically male fertile hermaphrodite, Simon D. Parvin, British Journal of Surgery, Volume 69, Issue 5, Mai 1982, Pages 279–280, DOI 10.1002/bjs.1800690517
- (en) The gonads of human true hermaphrodites, W. A. van Niekerk, A. E. Retief, 1981, DOI 10.1007/BF00284158
- « Orphanet: Dysgénésie gonadique 46,XX », sur www.orpha.net (consulté le )
- (en) True hermaphroditism: geographical distribution, clinical findings, chromosomes and gonadal histology, G. Krob, A. Braun, U. Kuhnle, DOI 10.1007/BF02000779
- Hôpital Debrousse, « Fetal intersexuality: management approach », Annales d'Endocrinologie, , p. 316-322 (lire en ligne)
- « Rapport d'information sur les variations du développement sexuel », Sénat de la République française, 2016-2017 (lire en ligne)
- Gregoire EP et al. (2011). “Transient development of ovotestes in XX Sox9 transgenic mice.” Dev Biol. 394(1):65-77
- Wilhelm D, Washburn LL, Truong V, Fellous M, Eicher EM, Koopman P. Antagonism of the testis- and ovary-determining pathways during ovotestis development in mice. Mechanisms of Development. 2009;126(5-6):324-336.
- (hu) Barna Páll-Gergely, « A Stylommatophora csigák ivarszervrendszerének magyar nyelvű nevezéktana », Malacological Newsletter, vol. 26, , p. 37-42 (lire en ligne)
- Chase R, Antkowiak T, Geoffroy E, Weatherill D, « Why the ovotestis of Helix aspersa is innervated », Acta Biol. Hung., vol. 55, nos 1–4, , p. 239–49 (PMID 15270240, DOI 10.1556/ABiol.55.2004.1-4.29)