Substitution électrophile aromatique
La substitution électrophile aromatique (ou SEA, voire SEAr) est une réaction organique au cours de laquelle un atome, en règle générale d'hydrogène, ou un groupe d'atomes, fixé à un cycle aromatique, est remplacé par un groupe électrophile. Cette réaction, la principale dans le groupe des substitutions électrophiles, est très importante en chimie organique, tant dans l'industrie qu'en laboratoire. Elle permet de préparer des composés aromatiques substitués par une grande variété de groupes fonctionnels suivant le bilan :
- ArH + EX → ArE + HX
avec ArH un composé aromatique et E un groupe électrophile.
Mécanisme général de la réaction modifier
La première étape du mécanisme est une addition au cours de laquelle le composé électrophile E+ réagit avec un doublet électronique du cycle aromatique. Cette étape nécessite généralement une catalyse par un acide de Lewis. Cette addition conduit à la formation d'un carbocation cyclohexadiénil connu sous le nom d’intermédiaire de Wheland[1] (ou complexe σ, ou encore cation arénium). Ce carbocation est instable, puisqu'il correspond à la fois à la présence d'une charge sur la molécule et à une perte d'aromaticité. Il est néanmoins stabilisé par mésomérie : la charge est en réalité délocalisée sur plusieurs atomes du cycle aromatique.
Au cours de la seconde étape, un atome d'hydrogène lié au cycle ayant subi l'addition électrophile part en tant qu'ion H+. Le doublet électronique qui était utilisé pour la liaison C-H permet alors au système de retrouver son aromaticité.

Principales substitutions électrophiles aromatiques modifier
Ce chapitre détaille les principales substitutions électrophiles aromatiques utilisées dans l'industrie et en laboratoire. Pour chacune d'entre elles, le mécanisme réactionnel est donné dans le cas particulier du benzène. Ce mécanisme est similaire pour d'autres types de composés aromatiques, aux conditions opératoires (température, solvant…) près.
Nitration aromatique modifier
La nitration aromatique est une substitution électrophile aromatique particulière au cours de laquelle un atome d'hydrogène lié à un atome de carbone du cycle aromatique est remplacé par un groupe nitro -NO2 pour former du nitrobenzène. L'électrophile utilisé pour la substitution est l'ion nitronium NO2+, produit in situ.
Dans la pratique, pour effectuer la substitution, le benzène est chauffé à 50 °C environ dans un mélange d'acide sulfurique et d'acide nitrique. Le schéma réactionnel est le suivant :
- (1) 2H2SO4 + HNO3 → 2HSO4− + NO2+ + H3O+
- (2) C6H6 + NO2+ → C6H5NO2 + H+
- (3) H+ + H3O+ + 2HSO4− → H3O+ + H2SO4 + HSO4−
L'acide sulfurique joue en quelque sorte le rôle de catalyseur pour la formation de l'ion nitronium. La réaction est également possible avec l'acide nitrique seul, mais elle est alors beaucoup plus lente. Parmi les autres réactifs utilisables pour la nitration aromatique, on peut citer le tétrafluoroborate de nitronium NO2BF4, qui est un sel de nitronium obtenu à partir de fluorure d'hydrogène, d'acide nitrique et de trifluorure de bore.


Si la réaction est catalysée en présence d'acide sulfurique, l'étape cinétiquement déterminante est la nitration du cycle benzénique pour former l'intermédiaire de Wheland. En présence d'acide nitrique seul, il s'agit de la formation de l'ion nitronium.
Le nitrobenzène formé au cours de cette réaction peut notamment être utilisé pour fabriquer de l'aniline par réduction :
- C6H5NO2 + 3H2 → C6H5NH2
Sulfonation aromatique modifier

La sulfonation aromatique est une substitution électrophile aromatique particulière au cours de laquelle un atome d'hydrogène lié à un atome de carbone du cycle aromatique est substitué par un groupe acide sulfonique. Dans le cas du benzène, la réaction permet de former de l'acide benzènesulfonique.
La substitution peut être réalisée de deux manières :
- le benzène est maintenu à 25 °C dans un oléum, solution de SO3 dans l'acide sulfurique (H2SO4) ou mélange de SO3 et d'eau (avec SO3 majoritaire). Le bilan de la réaction est :
- C6H6 + SO3 → C6H5SO3H
- le benzène est chauffé dans l'acide sulfurique concentré. SO3 est alors formé in situ par réaction de l'acide sulfurique sur lui-même. Le bilan de la réaction est :
- C6H6 + H2SO4 → C6H5SO3H + H2O
Dans les deux cas, le mécanisme réactionnel est le suivant :

Pour la sulfonation, l'élimination de l'atome d'hydrogène se fait par une réaction intramoléculaire.
Cette réaction ne possède pas d'étape cinétiquement déterminante.
Il s'agit d'une réaction réversible : il est possible d'éliminer le groupe acide sulfonique et de régénérer le benzène en chauffant l'acide benzènesulfonique dans une solution diluée d'acide sulfurique dans de l'eau surchauffée. Le bilan est :
- C6H5SO3H + H2O(vapeur) → C6H6 + HSO4− + H3O+
L'acide benzènesulfonique formé au cours de cette réaction est un intermédiaire de synthèse important dans l'industrie, utilisé par exemple dans la fabrication de colorants et de produits pharmaceutiques. Par ailleurs, il est possible de le réduire en présence de soude fondue pour former du phénol.
Halogénation aromatique modifier
L’halogénation aromatique est une substitution électrophile aromatique au cours de laquelle un atome d'hydrogène lié à un atome de carbone du cycle aromatique est substitué par un élément halogène suivant le bilan suivant :
- C6H6 + X2 → C6H5X + HX
La réaction n'est pas spontanée, mais nécessite la présence d'un catalyseur de type acide de Lewis. Elle s'effectue donc en milieu anhydre. Elle est possible sans catalyseur (mais est alors lente) dans le cas de cycles activés, comme le phénol. L'halogénation aromatique permet de substituer un atome d'hydrogène par un atome de chlore, de brome ou d'iode. En revanche, elle n'est pas possible avec le fluor. Celui-ci est en effet un oxydant puissant qui entraîne une dégradation du composé aromatique. Le mécanisme réactionnel est le suivant (exemple dans le cas d'une chloration) :
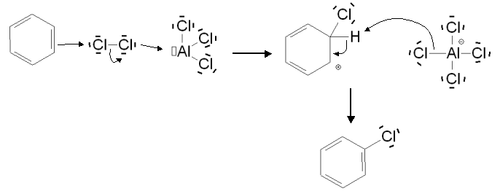
Au cours de la première étape du mécanisme, l'acide de Lewis utilisé comme catalyseur forme un complexe avec le dichlore, ce qui rend la liaison Cl-Cl polarisée. L'un des deux atomes de chlore devient donc électrophile, et peut subir l'attaque nucléophile du cycle aromatique, conduisant ainsi à la formation de l'intermédiaire de Wheland. L'anion formé contribue ensuite dans la deuxième étape à l'élimination de l'atome d'hydrogène et à la restauration de l'aromaticité.
Le catalyseur utilisé est généralement constitué du même élément halogène que celui agissant dans la substitution. Les acides de Lewis les plus couramment employés sont donc le chlorure de zinc ZnCl2, le chlorure d'aluminium AlCl3 et le chlorure de fer(III) FeCl3 dans le cas de la chloration, et le bromure de fer(III) FeBr3 dans le cas de la bromation. Dans le cas de l'iode, le mécanisme réactionnel est légèrement différent. En effet, le diiode I2 est trop peu réactif. Il doit d'abord réagir avec un oxydant (par exemple l'acide nitrique) pour former le cation I+, électrophile, qui interviendra dans l'iodation.
Les halogènes sont des éléments faiblement désactivants pour le cycle aromatique. En conséquence, si la réaction est catalysée et que l'halogène est présent en excès, il pourra se produire des polysubstitutions.
Réactions de Friedel-Crafts modifier
Les réactions de Friedel-Crafts sont des substitutions électrophiles aromatiques particulières au cours desquelles un cycle aromatique est alkylé (substitution d'un atome d'hydrogène par un groupe alkyle) ou acylé (substitution d'un atome d'hydrogène par un groupe acyle).
Alkylation modifier
L'alkylation de Friedel-Crafts est une réaction d'alkylation d'un composé aromatique. Cette réaction nécessite une catalyse par un acide de Lewis.
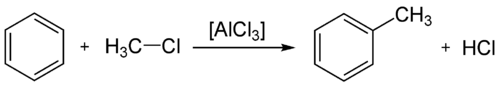
Acylation modifier
L'acylation de Friedel-Crafts est une réaction d'acylation d'un composé aromatique. Comme l'alkylation, elle nécessite une catalyse par un acide de Lewis. Les principaux catalyseurs utilisés sont le chlorure d'aluminium AlCl3 et le bromure d'aluminium AlBr3. Il y a en général plus besoin de catalyseur que les quantités stœchiométriques, car il complexe avec le produit formé, d'où la nécessité d'une hydrolyse après la réaction pour détruire le complexe.

Autres substitutions modifier
Réaction de Kolbe-Schmitt modifier
La réaction de Kolbe-Schmitt (ou procédé de Kolbe) est une réaction de carboxylation mise au point par A. Kolbe et R. Schmitt. Au cours de cette substitution électrophile aromatique, du phénolate de sodium (sel de phénol) est chauffé à 125 °C en présence de dioxyde de carbone sous une pression de 100 atm, puis traité par de l'acide sulfurique. Le bilan de la réaction est le suivant :
- C6H5OH + CO2 + NaOH + H2SO4 → C6H4OHCOOH + HSO4− + H2O + Na+

Au cours de la première étape (absente sur le schéma), le phénol réagit avec de la soude pour former le phénolate de sodium et des ions HO−. Le phénolate réagit ensuite avec le dioxyde de carbone par substitution électrophile aromatique, le centre électrophile étant ici l'atome de carbone du CO2. Les ions HO− formés au cours de la première étape assistent la restauration de l'aromaticité. Le composé obtenu étant la base conjuguée de l'acide carboxylique, la dernière étape consiste en une réaction acide-base avec l'acide sulfurique.
Le produit obtenu au cours de cette réaction est un acide β-hydroxylé (en) aromatique [ici l'acide salicylique, précurseur de l'aspirine (acide acétylsalicylique)].
Réactions avec des cycles aromatiques déjà substitués : les polysubstitutions modifier
Le produit d'une réaction de substitution électrophile aromatique est lui-même un composé aromatique : l'élimination d'un atome d'hydrogène permet de restaurer l'aromaticité de l'intermédiaire de Wheland (le carbocation intermédiaire). Rien ne s'oppose donc à ce que ce produit, qui est un cycle aromatique substitué, subisse de nouveau une substitution électrophile aromatique, tant qu'il reste des atomes d'hydrogène liés à des atomes de carbone. En réalité, tous les composés aromatiques substitués ne pourront pas subir une nouvelle substitution électrophile aromatique, et le produit issu d'une seconde réaction est dépendant du produit de départ : le groupe présent sur le composé substitué de départ influence à la fois la réactivité de ce composé (il peut ou non subir une seconde substitution) et la régiosélectivité de la réaction (tous les produits possibles ne sont pas formés).
Réactivité vis-à-vis de la polysubstitution modifier
Le groupe présent sur le composé substitué de départ influence fortement sa réactivité. Ces groupes sont classés en deux catégories : des groupes activants et des groupes désactivants. Un composé aromatique remplacé par un groupe activant est ainsi plus réactif que le composé aromatique non substitué. À l'inverse, un composé aromatique remplacé par un groupe désactivant est moins réactif. Ces règles ont été énoncées par le chimiste hollandais Arnold F. Holleman en 1910, elles sont connues sous le nom de règles de Holleman.
Groupes activants modifier
Un groupe activant est un groupe dont la présence augmente la réactivité du cycle aromatique vis-à-vis de la substitution électrophile aromatique par rapport au cycle pour lequel ce groupe est absent. Une substitution d'un cycle aromatique non remplacé par un groupe activant conduit fréquemment à une polysubstitution. La réactivité du cycle aromatique augmente s'il faut fournir moins d'énergie pour passer du composé de départ à l'intermédiaire réactionnel (intermédiaire de Wheland), autrement dit si l'écart énergétique entre le composé de départ et l'intermédiaire réactionnel est plus faible. C'est notamment le cas des composés mésomères donneurs, comme le groupe hydroxyle -OH. La figure ci-dessous montre la stabilisation par mésomérie du phénol et de l'intermédiaire de Wheland correspondant :
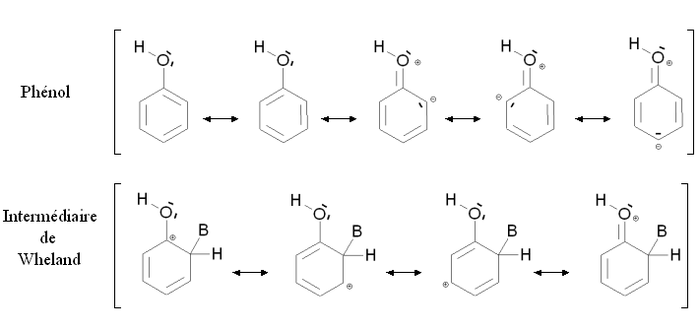
Le phénol et l'intermédiaire de Wheland sont tous deux stabilisés par mésomérie en délocalisant les électrons du cycle aromatique. Par ailleurs, il est possible d'écrire des formules mésomères mettant en jeu un doublet électronique de l'atome d'oxygène. Dans le cas du phénol, ces formes mésomères font apparaître des charges formelles sur l'oxygène et un atome de carbone, elles n'induisent donc qu'une faible stabilisation. Au contraire, dans le cas de l'intermédiaire de Wheland, aucune charge supplémentaire n'apparaît : la stabilisation est importante. L'intermédiaire de Wheland est donc plus stabilisé que le phénol par la présence du groupe -OH.

Cette situation est résumée sur la figure ci-contre, par comparaison avec le benzène (cycle aromatique non substitué). Les états fictifs (pointillés) correspondent à une situation où la présence du groupe -OH serait neutre, c’est-à-dire une situation où il n'interviendrait que par l'intermédiaire des doublets portés par l'oxygène. Dans ce cas, l'énergie du phénol et de l'intermédiaire de Wheland serait la même que dans le cas du benzène. Les traits pleins correspondent à la situation réelle : l'intermédiaire de Wheland est plus stabilisé que le phénol (son énergie est plus abaissée). En conséquence, l'écart énergétique entre le phénol et l'intermédiaire de Wheland ΔE2 est plus faible que cet écart dans le cas du benzène ΔE1. Le phénol est donc plus réactif que le benzène vis-à-vis de la substitution électrophile aromatique.
Globalement, sont activants tous les groupes qui peuvent stabiliser la charge positive de l'intermédiaire de Wheland, soit par mésomérie, soit par effet inductif, donc les groupes mésomères donneurs et inductifs donneurs.
Groupes désactivants modifier
Un groupe désactivant est un groupe dont la présence diminue la réactivité du cycle aromatique vis-à-vis de la substitution électrophile aromatique par rapport au cycle pour lequel ce groupe est absent. Une substitution d'un cycle aromatique non remplacé par un groupe désactivant ne conduit que très rarement à une polysubstitution. La réactivité du cycle aromatique diminue s'il faut fournir plus d'énergie pour passer du composé de départ à l'intermédiaire réactionnel (intermédiaire de Wheland), autrement dit si l'écart énergétique entre le composé de départ et l'intermédiaire réactionnel est plus important. C'est notamment le cas des composés mésomères attracteurs, comme le groupe nitro -NO2. La figure ci-dessous montre la stabilisation par mésomérie du nitrobenzène et de l'intermédiaire de Wheland correspondant :
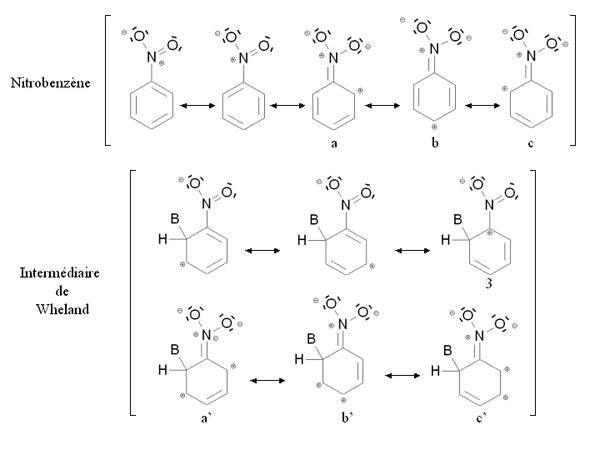
Le nitrobenzène et l'intermédiaire de Wheland sont tous deux stabilisés par mésomérie en délocalisant les électrons du cycle aromatique. Cependant dans le cas de la forme mésomère 3 de l'intermédiaire de Wheland, l'atome de carbone lié au groupe nitro (très électronégatif) est chargé positivement. Cette forme mésomère est donc très peu stabilisante : l'intermédiaire de Wheland est moins stabilisé que le nitrobenzène, et la présence du groupe nitro induit une déstabilisation par rapport à une situation où il serait absent. Par ailleurs, il est possible d'écrire des formules mésomères mettant en jeu un doublet électronique de l'atome d'azote (a, b, c et a', b', c'). Cependant dans le cas des formes mésomères b' et c' de l'intermédiaire de Wheland, deux charges positives sont portées par des atomes de carbone conjoints, ce qui correspond à une configuration très peu stable. De nouveau, l'intermédiaire de Wheland est moins stabilisé que le nitrobenzène.

Cette situation est résumée sur la figure ci-contre, par comparaison avec le benzène (cycle aromatique non substitué). Les états fictifs (pointillés) correspondent à une situation où le groupe -NO2 n'interviendrait que par l'intermédiaire des doublets portés par l'azote. L'état fictif de l'intermédiaire de Wheland est déstabilisé par rapport au benzène (à cause de la charge positive dans la formule mésomère 3). En revanche, le nitrobenzène n'est pas déstabilisé par rapport au benzène. Les traits pleins correspondent à la situation réelle : l'intermédiaire de Wheland est moins stabilisé que le nitrobenzène (son énergie est moins abaissée) à cause des charges portées par les atomes de carbone conjoints dans les formules mésomères b' et c'. En conséquence, l'écart énergétique entre le nitrobenzène et l'intermédiaire de Wheland ΔE2 est plus élevé que cet écart dans le cas du benzène ΔE1. Le nitrobenzène est donc moins réactif que le benzène vis-à-vis de la substitution électrophile aromatique.
Globalement, sont désactivants tous les groupes qui peuvent déstabiliser la charge positive de l'intermédiaire de Wheland, soit par mésomérie, soit par effet inductif, donc les groupes mésomères attracteurs et inductifs attracteurs.
Bilan : réactivité relative de quelques composés substitués modifier
La réactivité d'un composé aromatique substitué vis-à-vis d'une nouvelle substitution électrophile aromatique dépend donc fortement de la nature du substituant déjà présent. La réactivité est d'autant plus grande que le substituant apporte des électrons au système et stabilise les charges positives (effet mésomère donneur et effet inductif donneur). Le tableau ci-dessous donne ainsi quelques ordres de grandeur de réactivité (rapportée à celle du benzène, fixée à 1) de quelques benzènes substitués. Le phénol est ainsi 1 000 fois plus réactif que le benzène, et le nitrobenzène 10 000 fois moins.
| Substituant | -N(CH3)2 | -OH | -CH3 | -H | -Cl | -COOH | -NO2 |
| Réactivité | 9 000 000 | 1 000 | 25 | 1 | 0,3 | 4,10 × 10−3 | 1,10 × 10−4 |
Régiosélectivité modifier

Lorsqu'un composé aromatique substitué subit une seconde substitution électrophile aromatique, l'attaque peut a priori se faire depuis cinq positions. Parmi ces positions, deux sont des positions ortho, deux des positions méta et une est une position para (voir figure de droite).
De prime abord, on pourrait donc penser que le produit de la réaction est un mélange constitué à 40 % d'isomère ortho, à 40 % d'isomère méta et à 20 % d'isomère para, selon une répartition statistique (2 - 2 - 1). En réalité, ce n'est pas du tout le cas, et la régiosélectivité de la réaction (donc la nature du produit final) dépend fortement du groupe déjà présent sur le cycle aromatique substitué. Suivant la nature de ce groupe, la seconde substitution pourra se faire quasi exclusivement en méta, ou selon un mélange ortho + para.
Groupes ortho-para orienteurs modifier
Expérimentalement, une substitution électrophile aromatique utilisant comme produit de départ un cycle aromatique remplacé par un groupe donneur (mésomère donneur ou inductif donneur) conduit à un mélange d'isomères ortho et para, avec une quantité très faible d'isomère méta. Ce résultat s'explique par des considérations énergétiques simples.

Pour passer du composé de départ à un intermédiaire réactionnel au cours d'une réaction chimique, il faut fournir de l'énergie pour franchir une barrière de potentiel. La vitesse de la réaction est d'autant plus grande que cette barrière est faible, donc que l'intermédiaire réactionnel est stable. Dans le cas de la substitution électrophile aromatique, on peut considérer avec une bonne approximation que le produit final formé le plus rapidement est celui dont l'intermédiaire de Wheland est formé le plus rapidement (réaction sous contrôle cinétique). Il doit donc correspondre à l'intermédiaire de Wheland le plus stable.
La figure de droite montre les intermédiaires de Wheland correspondant aux composés ortho, méta et para dans le cas où le produit de départ est le phénol (mésomère donneur). Dans les trois cas, l'intermédiaire de Wheland est stabilisé par mésomérie en délocalisant la charge positive sur trois atomes de carbone. Dans le cas des composés ortho et para, la charge est également stabilisée par une mésomérie mettant en jeu un doublet électronique de l'atome d'oxygène. Ces deux intermédiaires sont donc nettement plus stables que l'intermédiaire méta, et la réaction conduit à un mélange constitué principalement des isomères ortho et para.
Globalement, un groupe donneur (mésomère donneur ou inductif donneur) est donc ortho-para orienteur. Si ce groupe est très volumineux, le composé final est majoritairement para (les positions ortho sont difficilement accessibles). Au contraire s'il est faiblement volumineux, le composé ortho est statistiquement favorisé (deux positions ortho pour une seule position para). Ainsi par exemple, la nitration du toluène (φ-CH3) conduit à un mélange d'isomères ortho (60 %), para (37 %) et méta (2 %) (le substituant est peu volumineux), alors que la nitration de l'anisole (φ-O-CH3) conduit à un mélange d'isomères ortho (34 %), para (65 %) et méta (1 %) (le substituant est relativement volumineux).
Groupes méta orienteurs modifier

Expérimentalement, une substitution électrophile aromatique utilisant comme produit de départ un cycle aromatique remplacé par un groupe attracteur (mésomère attracteur ou inductif attracteur) conduit principalement à l'isomère méta, avec une faible quantité d'isomères ortho et para.
Comme dans le cas des groupes ortho-para orienteurs, ce résultat s'explique par des considérations énergétiques simples en raisonnant sur la stabilité de l'intermédiaire de Wheland. La figure de droite montre les intermédiaires de Wheland correspondant aux composés ortho, méta et para dans le cas où le produit de départ est le nitrobenzène (mésomère attracteur). Dans les trois cas, l'intermédiaire de Wheland est stabilisé par mésomérie en délocalisant la charge positive sur trois atomes de carbone. Le groupe nitro étant attracteur, il ne stabilise jamais la charge positive par mésomérie. Pour l'une des formes mésomères des intermédiaires ortho et para, l'atome de carbone lié au groupe nitro porte une charge positive. Le groupe nitro étant très électronégatif, cette situation est très instable, et cette forme mésomère n'est quasiment pas stabilisante. Les intermédiaires ortho et para sont donc moins stables que l'intermédiaire méta, qui est donc formé plus rapidement.
Globalement, un groupe attracteur (mésomère attracteur ou inductif attracteur) est donc méta orienteur. Ainsi par exemple, une seconde nitration du nitrobenzène conduit à 92 % d'isomère méta, 7 % d'ortho et 1 % de para.
Cas particuliers des halogènes modifier
Les halogènes (principalement chlore, brome et iode) constituent un cas particulier, étant à la fois faiblement mésomères donneurs et faiblement inductifs attracteurs. Ces groupes sont faiblement désactivants (le chlorobenzène est environ trois fois moins réactif que le benzène) mais ortho-para orienteurs.
Tableau récapitulatif modifier
En résumé, les groupes donneurs sont activants (la réactivité est plus importante) et ortho-para orienteurs, et les groupes attracteurs sont désactivants et méta orienteurs. En règle générale, l'effet activant ou désactivant est d'autant plus important que le groupe est plus donneur ou attracteur. Le tableau ci-dessous répertorie les effets sur la réactivité et la régiosélectivité de quelques groupes fréquemment utilisés.
| Activant | Désactivant | |
|---|---|---|
| Puissants | -O−, -OH ortho-para orienteurs |
-NO2, -NR3+ (où R=H ou alkyle), -CCl3, -CF3 méta orienteurs |
| Moyens | -O-R, -NH-CO-R (où R=alkyle) ortho-para orienteurs |
-CN, -SO3H, -COOR, -CO-R (où R=H ou alkyle) méta orienteurs |
| Faibles | alkyles, aryles ortho-para orienteurs |
halogènes ortho-para orienteurs |
Substitutions mettant en jeu des composés hétérocycliques modifier
Les composés aromatiques hétérocycliques, comme le furane, le pyrrole ou la pyridine, peuvent également réagir par substitution électrophile aromatique. Leurs comportements vis-à-vis de polysubstitutions (réactivité et régiosélectivité) sont déterminés par les mêmes considérations énergétiques que dans l'exemple du benzène.
Références modifier
- G. W. Wheland, A Quantum Mechanical Investigation of the Orientation of Substituents in Aromatic Molecules, J. Am. Chem. Soc., 1942, 64(4), p. 900-908, DOI 10.1021/ja01256a047.
- Réaction de Kolbe-Schmitt
- (de) H. Kolbe, Annalen der Chemie und Pharmacie, no 113, 1860, p. 125.
- (de) R. Schmitt, « Beitrag zu Kenntniss der Kolbe'schen Salicylsäure-Synthese ». Dans Advanced Synthesis & Catalysis, no 31 [2], 1885, p. 397 texte sur Gallica.
- Présentations de la SEA
Voir aussi modifier
Articles connexes modifier
Liens externes modifier
- Notice dans un dictionnaire ou une encyclopédie généraliste :
