Thymome
| Spécialité | Oncologie |
|---|
| CIM-10 | D15 |
|---|---|
| CIM-9 | 164.0 |
| ICD-O | 8580 |
| DiseasesDB | 13067 |
| MedlinePlus | 001086 |
| eMedicine | 193809 |
| MeSH | D013945 |
Un thymome (de thymus, en grec ancien : θυμός, « excroissance charnue »), ou tumeur épithéliale thymique, est une tumeur solide développée aux dépens du thymus, un organe intrathoracique du système immunitaire. Les thymomes atteignent plutôt l'adulte. Il en existe plusieurs sortes, et ils sont généralement asymptomatiques, mais certains sont liés à des maladies systémiques comme la myasthénie (une maladie auto-immune caractérisée par une faiblesse musculaire) ou le syndrome de Good (une défaillance du système immunitaire).
Le diagnostic s'effectue habituellement par analyse radiologique ; le traitement est en premier lieu chirurgical. Malgré le caractère a priori bénin des thymomes, leur potentiel d'expansion incite à les prendre en charge comme des cancers.
Le pronostic des thymomes varie selon le type et le stade de la tumeur, mais demeure globalement bon. La plupart des thymomes sont en effet diagnostiqués à un stade précoce, permettant une action curative complète.
Généralités modifier
Le thymus est un organe décrit depuis la Grèce antique par Galien, qui y voyait le siège de l'âme. Il est situé entre le cœur et les poumons, et tire son étymologie du grec ancien : θυμός[1],[2],[Note 1], signifiant « excroissance charnue ».
Fonctionnement normal du thymus modifier

Le thymus est un organe intrathoracique, situé dans la loge thymique, dans le médiastin antérieur[3]. Cette zone est située entre les poumons, et à l'avant du cœur et des gros vaisseaux tels que l'aorte et ses branches[4]. Le thymus est constitué de deux lobes unis par le milieu, sauf à leurs extrémités supérieure et inférieure, appelées les cornes thymiques[5]. Le thymus comprend une région superficielle, appelée « cortex », et une région profonde, appelée « médulla ». Il grandit de la naissance jusqu’à la puberté, puis régresse progressivement[6].
Organe du système immunitaire[5], le thymus est spécialisé dans la maturation de certains lymphocytes, cellules du système immunitaire chargées de reconnaître et de détruire les cellules étrangères à l'organisme normal (cellules atteintes par un virus ou cellules cancéreuses, par exemple). Le cortex thymique est principalement composé de ces lymphocytes (aussi appelés thymocytes) ainsi que de quelques cellules épithéliales et mésenchymateuses[Note 2], tandis que la médulla est composée de nombreuses cellules épithéliales et quelques thymocytes[7]. C'est à partir des cellules épithéliales que se forment les thymomes[4].
Découverte historique de la maladie modifier

Ce n'est qu'au début du XXe siècle que débuta l'étude des maladies du thymus. La relation entre les tumeurs thymiques et la myasthénie, une maladie caractérisée par une faiblesse musculaire, fut décrite dès 1901[8] par le neurologue allemand Hermann Oppenheim. Ce dernier avait retrouvé, lors de l'autopsie d'un patient atteint de myasthénie, une tumeur développée aux dépens des reliquats thymiques. La même année, l'anatomopathologiste allemand Carl Weigert décrivit les caractères histologiques d'une de ces tumeurs[9],[10],[8]. Le caractère métastatique potentiel fut mis en évidence en 1905 par Edward Farquhar Buzzard.
C'est en 1900 que le terme « thymome » fut utilisé pour la première fois par Friedrich Wilhelm Grandhomme[11],[8]. Le terme recouvrait initialement toutes les tumeurs de la loge thymique, indépendamment de leur nature exacte. Il a été formé de la racine thym- extraite de « thymus » et du suffixe -ome attribué aux tumeurs bénignes[12],[Note 1].
Les premières thymectomies (chirurgie consistant à retirer le thymus)[8] furent réalisées par le chirurgien allemand Ernst Ferdinand Sauerbruch en 1911 par une voie d'abord cervicale. En 1939, Alfred Blalock et son équipe publièrent la première rémission de myasthénie après une thymectomie réalisée par sternotomie[13],[10],[8]. Blalock avait auparavant décrit la technique opératoire par sternotomie en 1936[10],[8].
Épidémiologie modifier
Les thymomes sont rares, avec une fréquence de 0,15 cas pour 100 000 habitants et par an dans le monde[14],[15]. On recense environ 250 nouveaux cas par an en France[16],[17]. Il s'agit toutefois des tumeurs du médiastin antérieur les plus fréquentes (50 % des cas sont des thymomes). Plus de 90 % des tumeurs thymiques sont situées dans le médiastin antérieur (la région située entre les poumons et à l'avant du cœur et des gros vaisseaux), les autres étant dans la région cervicale ou les autres régions du médiastin[14].
Les hommes et les femmes sont atteints de manière similaire par les thymomes[10]. Lorsque le thymome est associé à une myasthénie, il s'agit principalement d'adultes entre 30 et 40 ans et, lorsqu'il n'y a pas de myasthénie, on est plutôt dans la tranche d'âge entre 60 et 70 ans[14],[10],[18]. Si tous les âges de la vie peuvent être atteints par les thymomes[10], ces tumeurs sont très rares chez l'enfant[19] chez qui elles ne constituent qu'environ 4 % des tumeurs médiastinales[19], largement dominées par les lymphomes et les tumeurs germinales[20].
Il n'y a pas de facteur de risque connu[21], notamment génétique. Le caractère familial des thymomes est extrêmement rare et associé à une translocation chromosomique[22],[23]. Par ailleurs, les thymomes ne s'intègrent pas à des syndromes familiaux associant plusieurs cancers différents[24]. Il ne semble pas non plus exister de facteur favorisant de nature virale comme on peut en observer dans les cancers du col de l'utérus[25].
Manifestations cliniques modifier
Mode de découverte modifier
Le thymome peut être découvert à l’occasion d’une radiographie thoracique effectuée de manière systématique[17]. Dans plus de 60 % des cas, il est découvert de manière fortuite[17].
Dans la plupart des cas, il n'entraîne aucun symptôme[14],[7]. Cependant, quand la tumeur est évoluée et devient volumineuse, elle comprime les organes voisins : elle provoque ainsi une douleur au niveau du thorax et une gêne à la respiration, voire un syndrome cave supérieur (dilatation visible des veines de la partie supérieure du corps par engorgement sanguin)[7].
Signes cliniques modifier
Les thymomes sont souvent asymptomatiques : un tiers à la moitié des patients ne présentent pas de signes cliniques et le diagnostic est posé de manière fortuite lors d'examens réalisés pour une autre raison[14].
Lorsque les symptômes sont présents, ils sont dominés, dans 50 % des cas, par des syndromes paranéoplasiques et en premier lieu la myasthénie. D'autres symptômes (toux, syndrome cave supérieur, douleur ou oppression thoracique, difficultés à avaler et essoufflement), liés à l'effet de masse sur les organes intrathoraciques, concernent 40 % des patients[26]. Enfin, environ 30 % des patients présentent des signes généraux tels la fatigue ou une perte de poids qui peuvent se combiner aux symptômes déjà énumérés[10].
Bilan biologique modifier
Il n'existe pas de marqueur sanguin spécifique qui soit dosable. En présence d'un thymome, il faut cependant rechercher les anticorps associés à la myasthénie[27] (anticorps anti-récepteur de l'acétylcholine et anti-MuSK).
Imagerie modifier
Les examens d'imagerie réalisés comprennent en général en premier lieu une radiographie thoracique, puis un scanner thoracique[28]. L’envahissement des ganglions et les métastases doivent être recherchés au cours du bilan[14].
Radiographie thoracique modifier
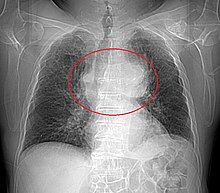
La radiographie thoracique permet de visualiser entre 45 % et 80 % des tumeurs thymiques[29]. De face, elles présentent un aspect bien délimité, parfois lobulé, débordant d'un côté du médiastin. Le profil permet d'affirmer le caractère rétrosternal de la tumeur, et donc sa localisation dans le médiastin antérieur. Les signes d'envahissement sont rares et peu visibles, et comprennent principalement l'ascension d'une coupole diaphragmatique, faisant suspecter un envahissement du nerf phrénique[28].
Scanner thoracique modifier
Le scanner thoracique est plus précis que la radiographie thoracique dans le diagnostic des thymomes, en raison d'une plus grande sensibilité envers les masses médiastinales. L'injection de produit de contraste iodé n'est pas forcément nécessaire, mais permet de préciser les rapports du thymome avec les structures vasculaires. Ceci permet à la fois la stadification et de préciser la stratégie chirurgicale lorsqu'elle est envisagée[28].
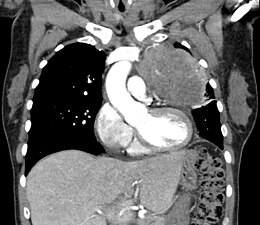
Les thymomes se présentent comme une masse bien définie du médiastin antérieur, proche du péricarde et dans un plan plus antérieur que les gros vaisseaux intrathoraciques (aorte ascendante et sa crosse, artère pulmonaire, veine cave supérieure). La masse peut être sphérique ou lobulée, mais présente un aspect homogène (plus rarement kystique) qui se réhausse après injection et peut contenir des calcifications[29].
Les critères scanographiques d'envahissement local doivent être recherchés car ils guideront le traitement. D'autre part, l'envahissement scanographique est corrélé au pronostic[30]. L'absence d'un liseré graisseux entre la masse et les vaisseaux, notamment l'aorte et la veine cave supérieure, est un signe d'envahissement local. L'ascension d'une coupole diaphragmatique, comme en radiographie thoracique, est un signe d'envahissement du nerf phrénique[31].
L'irrégularité des contours de la tumeur, ainsi que la présence de calcifications, de nécrose ou d'hémorragie intratumorale sont des signes de mauvais pronostic corrélés à des tumeurs plus agressives[32].
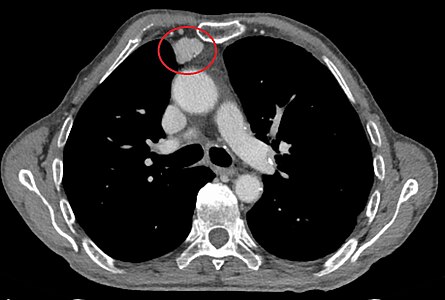
- Aspect scannographique
-
Présentation tomodensitométrique classique d'un thymome à un stade précoce (cercle rouge). À l'arrière, l'aorte, la veine cave supérieure et l'artère pulmonaire sont visibles en coupe.
-
Scanner injecté, en fenêtre médiastinale, montrant un carcinome thymique envahissant les structures médiastinales :
1 : tumeur hétérogène, aux contours irréguliers, présentant des plages hémorragiques ;
2 : veine cave supérieure ;
3 : tronc artériel brachiocéphalique ;
4 : artères sous-clavière gauche et carotide commune gauche ;
5 : crosse de l'aorte ;
6 : sternum. -
Scanner en fenêtre parenchymateuse, montrant un carcinome thymique envahissant les poumons (avec des lésions d'emphysème) au contact des deux poumons (1 : poumon droit ; 2 : poumon gauche) ;
flèches noires : zones suspectes d'envahissement.
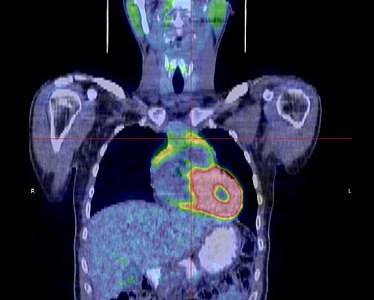
La place du TEP scanner dans le diagnostic des thymomes est encore débattue[31]. S'il existe bien une hyperfixation de la tumeur, son rôle dans le diagnostic de l'extension locorégionale reste à préciser[33].
- Thymome de type B1 en TEP scanner
-
Coupe transversale. Les trois clichés sont extraits du même examen.
-
Coupe frontale ; la tumeur est à l'intersection des lignes rouges.
-
Coupe sagittale ; la tumeur est à l'intersection des lignes rouges.
IRM modifier
L'imagerie par résonance magnétique est peu utilisée dans le diagnostic des thymomes, mais peut être utile dans certains cas. Ainsi, un patient ne pouvant recevoir d'injection de produit de contraste iodé lors du scanner pourra tirer bénéfice de l'IRM, afin d'évaluer l'extension locorégionale. L'IRM peut également aider à différencier un thymome kystisé secondairement (comportant une cavité liquidienne) d'un kyste médiastinal congénital[28].
Les thymomes ne présentent pas de caractéristique spécifique à l'IRM. Une IRM est analysée principalement en deux séquences, appelées T1 et T2, qui permettent de distinguer les différents tissus. En séquence T1 le signal d'un thymome est proche, ou plus important, que celui des muscles, alors qu'en séquence T2 il s'approche de celui de la graisse, rendant difficile de distinguer les berges du thymome au milieu de la graisse médiastinale. Tout comme au scanner, une hétérogénéité tumorale est associée à des tumeurs plus agressives, mais il s'agit d'un signe inconstant et peu fiable non utilisé en clinique courante[28].
Maladies associées modifier
Les thymomes se présentent le plus souvent de manière isolée. Toutefois, ils peuvent être accompagnés d'un syndrome paranéoplasique[17]. Ce terme recouvre l'ensemble des anomalies pouvant accompagner certaines tumeurs. Ces anomalies ne sont pas en relation directe avec la tumeur, mais sont des manifestations survenant à distance de l'endroit où se développe le cancer, par production d'une substance par la tumeur. Il s'agit de syndromes rares, surtout retrouvés dans une minorité des cancers intrathoraciques et digestifs. Le syndrome paranéoplasique accompagne parfois la tumeur dans son évolution : il la précède souvent, régresse parfois avec son traitement, disparaît avec la guérison et réapparaît en cas de rechute. Son traitement consiste à traiter la tumeur responsable. Les syndromes paranéoplasiques les plus fréquemment rencontrés dans les thymomes sont dominés par la myasthénie[18].
Myasthénie modifier
La myasthénie est une maladie neuromusculaire auto-immune. Elle est caractérisée par une atteinte de la jonction neuro-musculaire entraînant une faiblesse fluctuante de la musculature striée squelettique et une fatigabilité excessive.
Entre 15 et 20 % des patients atteints d'un thymome présentent également des signes cliniques de myasthénie, et 25 % des patients présentent des anticorps anti-récepteurs de l'acétyl-choline (anticorps anti-ACh-R) sans avoir de symptomatologie. Tout porteur d'un thymome présentant des signes de myasthénie aura des anticorps positifs, et toute masse médiastinale asymptomatique associée à des anticorps anti-ACh-R est un thymome. Si l'association statistique suggère bien une corrélation entre les deux pathologies, le mécanisme exact de cause à effet demeure débattu et plusieurs hypothèses sont envisagées[27] :
- sélection de lymphocytes T défectueux au sein du thymome, responsables de l'hypersécrétion de l'auto-anticorps ;
- présentation défectueuse des auto-antigènes aux cellules thymiques, menant à la non-élimination des lymphocytes T les reconnaissant ;
- présence de centres germinaux spécifiques au sein du parenchyme thymique produisant plus volontiers les auto-anticorps ;
- chez les sujets âgés, présence d'une auto-immunité aspécifique.
En cas de myasthénie, il convient de réaliser un scanner thoracique à la recherche d'un thymome[27].
Tous les types de thymomes ne sont pas associés de manière identique à une myasthénie, certains n'y étant même jamais associés[34].
| Fréquence observée | |
|---|---|
| Type A | 0 % |
| Type AB | 6,8 % |
| Type B1 | 40 % |
| Type B2 | 55,6 % |
| Type B3 | 10 % |
| Carcinomes thymiques | 0 % |
Syndrome de Good modifier
Le syndrome de Good est une immunodépression acquise associée aux thymomes, décrite pour la première fois en 1954[35]. Il se manifeste par des infections à répétition. Bien qu'il n'existe pas de critères diagnostics stricts[36], le syndrome de Good est reconnu et classifié comme entité distincte par les comités d'experts internationaux[37].
Il existe une hypogammaglobulinémie (carence en protéines sanguines participant au système immunitaire par la réponse humorale) et une leucopénie (carence en globules blancs) touchant principalement les lymphocytes B et entraînant un déficit de l'immunité cellulaire (mécanisme de défense immunitaire impliquant les lymphocytes)[38]. Le mécanisme d'apparition de la maladie est inconnu, mais il trouve sans doute son origine dans la moelle osseuse[38].
La fréquence du syndrome de Good varie selon les études. Pour certains, une hypogammaglobulinémie est présente chez 6 à 11 % des patients atteints d'un thymome, et environ 10 % des adultes présentant une hypogammaglobulinémie ont également un thymome[36]. Cependant, la plus grande cohorte de tumeurs thymiques à ce jour rapporte une fréquence de moins de 1 % de l'hypogammaglobulinémie[39].
Autres syndromes paranéoplasiques modifier
D'autres symptomatologies regroupent l'érythroblastopénie, le syndrome de Morvan, des encéphalites, et des myosites[14]. Leur présence doit faire rechercher un thymome, et la symptomatologie s'améliore habituellement avec le traitement de ce dernier[40]. Plus rarement, on peut observer des maladies telles que le lupus érythémateux disséminé, la polyarthrite rhumatoïde, un syndrome de Sjögren, ou une colite ulcérative. Le lien de cause à effet pour ces maladies est contesté, car il s'agit de maladies assez fréquentes chez les personnes n'ayant pas de thymome, et très rares chez celles en ayant un[10].
Diagnostic modifier
Stratégie diagnostique modifier
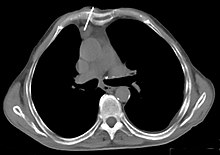
La plupart du temps, un diagnostic clinicoradiologique est suffisant, typiquement dans le cas d'un nodule petit et bien délimité développé dans la loge thymique[14],[18]. Un diagnostic de certitude par une biopsie (prélèvement d'un échantillon de tissu pour analyse microscopique) peut toutefois être nécessaire avant d'instaurer un traitement, dans le cas d'un envahissement local important rendant une approche chirurgicale impossible au moins dans un premier temps. La biopsie est également requise en cas de fort doute diagnostic entre un thymome et un lymphome, pour lequel le traitement serait alors très différent[10].
Lorsqu'elle est nécessaire, une biopsie peut être réalisée de plusieurs manières[31],[18]. Les biopsies chirurgicales (principalement par médiastinotomie) permettent d'établir un diagnostic dans 90 % des cas, mais nécessitent une anesthésie générale. Une biopsie à l'aiguille réalisée sous scanner ne nécessite pas d'anesthésie générale et est moins invasive, mais ne permet un diagnostic que dans 60 % des cas. Le choix de la technique se fait selon l'accessibilité de la tumeur par chaque voie d'accès[31], et l'état général du patient[41],[42].
Diagnostics différentiels modifier
D'autres diagnostics peuvent être évoqués devant une tumeur occupant la loge thymique[10]. Il peut s'agir de tumeurs bénignes, par exemple d'un goitre ectopique (thyroïde anormalement positionnée à l'intérieur du thorax plutôt que dans le cou), d'un adénome parathyroïdien lui aussi ectopique, mais encore d'un lipome ou d'un tératome. Une origine vasculaire est également possible (anévrysme)[31]. Dans d'autres cas, il peut s'agir de tumeurs malignes n'étant pas nées du tissu thymique, telles que les sarcomes et les séminomes, ou d'hémopathies malignes telles que les lymphomes[31],[18].
Anatomie pathologique modifier
Historique modifier

Historiquement, la classification histologique des thymomes pose un défi aux anatomopathologistes en termes d'identification.
Ainsi, l’anatomopathologiste américain James Ewing écrit en 1916[43] qu’« aucun autre groupe de tumeurs n'a aussi bien résisté à l'interprétation et à la classification que celles du thymus. Parmi tous les problèmes rencontrés, on pense notamment à ceux qui ont compliqué l'étude embryologique et histologique de cette glande, auxquelles se sont jointes les difficultés dues à leur relative rareté et à leur considérable diversité, ainsi qu'à des connaissances imparfaites de la pathologie générale du thymus[Note 3] .»
L'International Thymic Malignancy Interest Group (ITMIG, Groupe d'intérêt international des néoplasies thymiques) est fondé en 2010 dans le but de coordonner l'étude et les recommandations diagnostiques et thérapeutiques des thymomes[44].
Classification histologique modifier
L'histologie est l'étude des tissus biologiques. Dans le cadre des tumeurs, elle s'attache à l'identification de l'architecture des tissus, mais aussi aux divers récepteurs qu'ils expriment, afin d'identifier et de classifier les tumeurs. Elle apporte le diagnostic de certitude et permet d'orienter le traitement.
Grands types de thymomes modifier
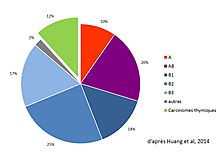
Les thymomes se développent à partir des cellules épithéliales thymiques, d'où leur nom global de « tumeurs épithéliales thymiques ». Les tumeurs de la loge thymique développées à partir d'autres types de cellules ne sont pas des thymomes. Ainsi, les lymphomes atteignant le thymus ne doivent pas être considérés comme appartenant aux thymomes, de même que les tumeurs localisées dans le médiastin antérieur et développées à partir de cellules non natives du thymus (tumeur fibreuse solitaire, lipome, liposarcome, tumeurs germinales...)[45].
Les tumeurs épithéliales thymiques sont classées selon la classification de l'OMS réactualisée en 2003, puis en 2015[46],[47] en thymomes (de type A, AB, B1, B2 ou B3) et carcinomes thymiques[48]. Les tumeurs neuroendocrines thymiques sont encore une autre entité, très rare (moins de 5 % des tumeurs thymiques et moins de 200 cas rapportés[14]), décrite en 1972[49]. Un consensus international publié en 2014 par le groupe ITMIG précise les critères permettant de définir exactement les sous-types histologiques[46].
Histologie modifier
La classification histologique de l'OMS identifie les thymomes selon la forme des cellules malades, réparties en type A (ovalaires ou en fuseau) et en type B (dendritiques ou épithélioïdes). Les différents types B sont différenciés par la proportion de thymocytes et de cellules atypiques par rapport à la quantité de lymphocytes ; les types B1 sont plus riches en lymphocytes et les types B3 en sont plus pauvres. Les thymomes comportant à la fois des caractéristiques de type A et de type B1 sont dits de type AB[31],[46]. Les carcinomes thymiques, eux, présentent les caractéristiques histologiques générales des carcinomes[46].
Il existe des critères majeurs et mineurs permettant de classer les différentes formes[46].
| Type A | Type AB | Type B1 | Type B2 | Type B3 | Carcinomes thymiques | |
|---|---|---|---|---|---|---|
| Forme des cellules épithéliales | fusiformes | fusiformes/polygonales | polygonales | polygonales | polygonales | |
| Atypies cellulaires | minimes | minimes | minimes | faibles | modérées | importantes |
| Quantité de lymphocytes | rares | intermédiaires | abondants | intermédiaires | rares | très rares |
Épidémiologie modifier
Les types B2 sont les plus fréquents thymomes avec 25 à 28 % du total, et le type B1 est le plus rare (10 à 12 %)[39]. La répartition des types histologiques varie avec l'âge (les types A et AB sont plus fréquents chez les patients de plus de 55 ans), mais pas avec le sexe.
Les thymomes de types A et AB sont moins souvent envahissants localement, 90 % de ces tumeurs étant à des stades précoces. En revanche, les types B1, B2 et B3 sont plus souvent localement avancés (62 % de ces tumeurs sont à un stade III)[51].
On observe des variations dans la répartition géographique, les types A et B2 étant moins fréquents en Asie qu'en Europe et en Amérique du Nord, au contraire des types AB et B3. Les thymomes B1 sont en revanche répartis de manière harmonieuse entre ces régions. Il n'existe cependant pas de données pour le continent africain[51].
Immunohistochimie modifier
Chaque type de thymome exprime de manière variable certains antigènes. Leur identification par immunomarquage permet de préciser le type de tumeur, l'aspect histologique seul étant parfois insuffisant[46].
Les anticorps anti-cytokératines marquent nettement les thymomes mais ne permettent cependant pas de différencier de façon fiable des cellules épithéliales médullaires et corticales. Les cytokératines sont utilisées essentiellement dans le diagnostic différentiel des types A et B[46].
Les thymomes associés à une myasthénie expriment plus fortement l'antigène CD57. L'expression de l'antigène CD5 est d'un intérêt limité car pouvant être exprimée par toutes les formes de thymomes et de carcinomes thymiques[52].
| Type A | Type AB | Type B | Carcinomes thymiques | |
|---|---|---|---|---|
| CD20 | positif | positif | négatif | négatif |
| Calrétinine | négative | négative | négative | positive dans 30 % des cas |
| Vimentine | positive | positive | négative | négative |
| Mésothéline | négative | négative | négative | positive dans 30 % des cas |
| CD57 | positif | positif | positif | négatif |
Stadification modifier

En cancérologie, la stadification est la classification standardisée des tumeurs selon leur extension locale, régionale et à distance[53]. La stadification des thymomes la plus couramment utilisée n'est pas de type TNM[Note 4] comme pour la majorité des tumeurs solides[54]. En raison de la grande variabilité morphologique des thymomes, la stadification, comme la classification histologique, a fait et fait encore débat dans la communauté médicale[55] et plusieurs stadifications ont été utilisées simultanément dans le monde[56].
La première tentative de classification en stades évolutifs des tumeurs thymiques remonte à 1978 : elle est due à Nils P. Bergh et son équipe[57]. Elle établit trois stades, selon le niveau d'envahissement local par la tumeur. Ce système est légèrement modifié l'année suivante par l'équipe du Massachusetts General Hospital[58]. Ces deux classifications sont critiquées pour leur manque de précision concernant l'envahissement des organes adjacents et la dissémination intrathoracique ou à distance[15].
C'est en 1981 que le chirurgien japonais Akira Masaoka développe la classification qui porte son nom et qui est très largement utilisée par la suite[59],[53]. Cette classification, basée sur l'envahissement des structures adjacentes et non la taille de la tumeur, est la première dont le stade est corrélé à la survie[15].
La classification de Masaoka est modifiée en 1994 pour devenir la classification de Masaoka-Koga[60], qui est la plus utilisée désormais dans le monde[61] bien que critiquée sur plusieurs points, notamment sur la corrélation entre aspect clinique et aspect microscopique et à cause d'une ambiguïté sur certains stades[15],[62],[63]. Enfin, la classification de Masaoka n'est pas utilisable pour les carcinomes thymiques[64],[65].
- Stades de Masaoka-Koga
-
Stade I
Tumeur encapsulée. -
Stade II
Envahissement de la graisse adjacente. -
Stade III
Envahissement de contiguïté des organes adjacents.
Afin de tenter de remédier à ce problème, une classification de type TNM est proposée en 1991, principalement à destination des carcinomes thymiques[67]. Les études plus récentes invalident cependant son caractère pronostique pour les carcinomes thymiques[64],[65]. Une nouvelle classification spécifique à ces tumeurs est donc introduite en 1994[64].
En 2005, une nouvelle classification TNM des thymomes est proposée[68], reprenant les grandes lignes de la classification de 1991, mais en précisant davantage certains éléments, notamment la qualité de la résection chirurgicale. Cette classification est demeurée en cours de validation et n'a jamais été largement utilisée afin de guider les traitements[55].
En 2014, le groupe ITMIG et l'Association Internationale pour l'Étude du Cancer du Poumon (International Association for the Study of Lung Cancer, IASLC) mettent en place une nouvelle classification TNM. Pour la première fois, et grâce à la mise en place d'un registre international, un grand nombre de dossiers de patients du monde entier peut être étudié, permettant une analyse statistique plus fine[56]. En effet, la classification de Bergh (1978) était issue de l'étude de 43 patients[57], celle du Massachusetts General Hospital de 103 patients[58] ; 93 pour Masaoka[59] et 79 pour Koga[60]. La classification TNM de 1991 était basée sur 107 patients[67]. La raison principale de ce faible nombre de patients est la rareté des thymomes et c'est la limite des classifications anciennes. Les thymomes présentent en effet une grande variabilité clinique et histologique, qui se reflète dans l'inadéquation partielle de certains aspects de ces classifications. Pour ces raisons, aucune classification n'avait été adoptée sur le plan international, chaque société savante émettant ses propres recommandations basées sur la classification qu'elles estimaient correspondre le mieux à leur population de patients[56].
La base de données utilisée pour l'établissement de la classification de l'ITMIG compile les dossiers de 1 808 patients issus de 105 centres à travers le monde, et la classification devrait être intégrée à la 8e édition de la classification TNM des tumeurs malignes, lui conférant une valeur de référence internationale[69].
Traitement modifier
Le groupe ITMIG rapporte[39] que, dans le monde, 47,1 % des patients sont traités par chirurgie seule. Une radiothérapie combinée à la chirurgie est proposée à 26,7 % des patients ; 6,5 % des patients reçoivent une chirurgie et une chimiothérapie, et enfin 18,4 % bénéficient d'un traitement associant chirurgie, radiothérapie et chimiothérapie. Les thymomes sont considérés comme des tumeurs bénignes, et leur évolution est lente, généralement asymptomatique. Ils présentent toutefois un potentiel de malignité en raison de la possibilité d'envahissement local et de métastases régionales (plèvre et péricarde), et relèvent donc d'un traitement curatif radical dès les stades précoces[70].
Chirurgie modifier
Indications modifier
Le traitement premier des thymomes est la résection chirurgicale complète[18], en particulier pour les stades précoces. Il relève de la chirurgie thoracique.
Bien que le traitement chirurgical doive tendre à la résection la plus complète possible, l'intérêt d'une chirurgie de réduction de volume tumoral (debulking) fait débat dans le cas des thymomes trop avancés localement et qu'il est impossible de retirer en totalité[10]. Certains auteurs estiment qu'une résection incomplète suivie d'un traitement adjuvant à base de radiothérapie et de chimiothérapie permet une meilleure survie qu'un traitement purement médical. Toutefois, dans la plupart des études, le gain de survie est faible, et seules deux études montrent un gain appréciable[71],[72]. Il est possible que le bénéfice retiré d'un debulking suivi d'un traitement adjuvant ne soit observable qu'à moyen terme et disparaisse à long terme. Les études plus récentes, en revanche, ne concluent pas à un gain de survie significatif après debulking[10],[73],[74], préconisant un traitement par radiochimiothérapie seule à la place.
Afin de s'affranchir des biais méthodologiques liés au faible nombre de patients de ces études, une méta-analyse portant sur 13 études, pour un total de 314 patients, est réalisée en 2015[75]. Les auteurs concluent qu'un debulking peut améliorer le pronostic, mais avec des réserves liées à la méthodologie des études utilisées, au faible nombre de patients et à une grande hétérogénéité des traitements adjuvants réalisés. Une autre réserve concerne l'envahissement des gros vaisseaux et la présence de métastases pleurales, qui ne semblent pas bénéficier d'un debulking.
Techniques chirurgicales modifier
Deux voies d'abord principales sont utilisées : la sternotomie (« thymectomie trans-sternale ») et la vidéothoracoscopie (« thymectomie vidéo-assistée », qui peut être pratiquée assistée par un robot[76]). D'autres abords mini-invasifs sont également décrits[77], notamment par voie cervicale[78],[79] ou , en particulier chez l'enfant, la médiastinoscopie[80]. Le terme « mini-invasif » désigne l'ensemble des techniques ne comportant pas de sternotomie ni d'écartement des côtes[77].
Le choix de la voie d'abord se fait selon les caractéristiques du thymome. Il n'existe pas d'étude randomisée comparant les deux techniques ; seules des comparaisons a posteriori sont disponibles en 2016[81]. La voie trans-sternale est longtemps restée la voie d'abord de référence ; encore aujourd'hui, on reconnaît l'excellente qualité de l'exposition de la loge thymique qu'elle permet, afin de réaliser un évidement complet de celle-ci[82]. Toutefois, le développement des techniques moins invasives a permis de diminuer les complications et la lourdeur de l'intervention tout en conservant une qualité de résection similaire[81],[83]. Les voies vidéo-assistées sont recommandées pour les thymomes de petite taille et de stade précoce[83], et permettent alors de diminuer la durée de séjour hospitalier, la douleur post-opératoire et d'avoir un meilleur résultat esthétique[81]. Il faut cependant noter que les patients bénéficiant d'une chirurgie vidéo-assistée sont sélectionnés justement pour le caractère moins avancé du thymome[84]. Le moindre taux de complications post-opératoires peut donc être simplement dû au fait qu'il s'agit de tumeurs techniquement plus faciles à retirer, sans bénéfice propre à la technique[81].
- Voies d'abord utilisées
-
Incision de sternotomie médiane pour une thymectomie trans-sternale.
-
Incisions des orifices de trocarts pour une thymectomie vidéo-assistée par voie gauche.
-
Incision de cervicotomie pour une thymectomie trans-cervicale.
Sur le plan technique, chaque voie d'abord présente des avantages et des inconvénients. La voie trans-sternale est réalisée par une sternotomie médiane, la cicatrice parcourant toute la hauteur du sternum. On s'expose ainsi au risque d'infection du sternum, et l'ensemble de la cavité pleurale n'est pas facilement accessible[82]. En revanche, il est facile d'étendre l'incision au cou, en cas d'une tumeur cervicothoracique, et de réaliser une exérèse devant emporter les organes adjacents : pneumonectomie ou lobectomie pulmonaire et geste sur les gros vaisseaux du médiastin ne sont possibles de manière optimale que par cette voie d'abord[82].
La voie vidéothoracoscopique et la voie robotique sont très similaires[76], la chirurgie assistée par robot étant un prolongement technologique de la chirurgie vidéo où l'opérateur gagne simplement des degrés de liberté au niveau de la manipulation des instruments, qui se fait à partir d'une console située dans la salle d'intervention. Plutôt qu'à travers le sternum, le thymus est abordé par l'une des cavités pleurales. Un abord vidéothoracoscopique nécessite donc une ventilation unipulmonaire afin de dégager un espace de travail suffisant (dans le cas contraire, le poumon gonflé d'air occupe toute la cavité pleurale et empêche le passage des instruments)[76]. La ventilation sur un seul poumon est permise par une intubation sélective lors de l'anesthésie. Par ailleurs, l'insufflation à faible pression de CO2 peut faciliter tant l'exposition que la dissection des structures en achevant de repousser le poumon loin de la zone de travail[85].
Quelle que soit la voie d'abord retenue, en fin d'intervention d'une thymectomie radicale, la loge thymique doit être vide de toute graisse résiduelle[82].
Étendue de la résection modifier
Il existe actuellement un débat sur la possibilité de réaliser une simple thymomectomie (ablation du nodule thymique) plutôt qu'une thymectomie radicale (évidement complet de la loge thymique) pour les thymomes de petite taille sans critères d'agressivité à l'imagerie. Chez les patients ne présentant pas de myasthénie, et dont le thymome est de petite taille, une thymomectomie seule semble acceptable, avec une survie à 5 ans identique. En revanche, on manque de données à long terme[86].
Dans certains cas, il convient de réaliser en plus un curage ganglionnaire[87]. Les tumeurs localement avancées, ainsi que les carcinomes thymiques, sont sources d'envahissement ganglionnaire : l'intervention doit donc comporter un curage au moins paratrachéal droit et du médiastin antérieur[88]. C'est un geste qui peut être difficile par un abord vidéochirurgical, mais non par sternotomie, qui est la voie d'abord recommandée pour ce type de tumeurs plus agressives. L'intérêt du curage réside principalement dans l'obtention d'un stade le plus fiable possible, permettant de guider le traitement post-opératoire[89]. En cas d'envahissement de contiguïté des organes voisins, il est recommandé de réaliser une résection monobloc de la tumeur et des organes envahis[82].
Gestion périopératoire d'une myasthénie associée modifier
Il n'existe pas de consensus international sur la gestion péri-opératoire de la myasthénie chez les patients opérés d'un thymome[90]. Cependant, une littérature médicale abondante existe sur le sujet, permettant à diverses sociétés savantes d'établir des recommandations[90],[91].
Des facteurs de risque de crise myasthénique en post-opératoire ont été identifiés[92], et comprennent la présence d'anticorps anti-récepteurs de l'acétylcholine, les histologies de type B1, B2 ou B3, et le caractère incomplet de la résection. Chez les patients présentant une myasthénie en pré-opératoire, une rechute de la myasthénie est possible jusqu'à deux ans après l'intervention[93] ; chez ces patients, une insuffisance respiratoire pré-opératoire est un facteur de risque de récidive de la myasthénie[93]. Cependant, le stress chirurgical seul est un facteur de risque de crise myasthénique[94].
Les médicaments anticholinestérasiques (pyridostigmine en particulier) sont souvent administrés en traitement de fond avant la chirurgie[90]. En revanche, en raison de leurs effets indésirables à type de vomissements et de troubles du rythme cardiaque, ils sont arrêtés le matin de la chirurgie[95]. La reprise, en général après le deuxième jour post-opératoire, doit être guidée par les symptômes et se faire de manière progressive[90].
Les corticoïdes oraux (notamment la prednisolone) font eux aussi souvent partie du traitement de fond des patients myasthéniques[90]. En raison de la majoration du risque de complications post-opératoires lié à la corticothérapie (difficultés de cicatrisation en premier lieu), en cas de myasthénie modérée, il est possible d'arrêter le traitement plusieurs semaines avant l'intervention[90]. Si le traitement anticholinestérasique seul est alors insuffisant à contrôler les symptômes, d'autres types de traitements peuvent être transitoirement réalisés, comme la plasmaphérèse[96], qui peut également être réalisée de principe indépendamment des symptômes[91]. Pour les patients qui ont reçu des corticoïdes à long terme avant la chirurgie, le traitement doit être repris précocement[96]. En cas de crise aiguë myasthénique en post-opératoire, il est possible de réaliser, avec précautions, de courtes corticothérapies intraveineuses à forte dose[97].
Dans le cas de myasthénies sévères, plusieurs séances de plasmaphérèse (3 à 5 en général) peuvent être réalisées avant l'intervention[91]. L'efficacité est observée en environ une semaine, et dure de 1 à 3 mois[90].
En absence de crise myasthénique sévère en post-opératoire, il n'est pas recommandé de traitement par immunoglobulines[90],[91].
Traitement multimodal modifier
De par la faible fréquence des thymomes, peu d'études randomisées sont disponibles ou réalisables[7], ce qui limite les données disponibles sur les modalités de traitement[7], et principalement les indications de traitement dit adjuvant[74].
Un traitement adjuvant est une chimiothérapie ou une radiothérapie réalisée après une chirurgie, afin de diminuer le risque de récidive, alors qu'un traitement néoadjuvant a lieu avant une chirurgie, afin d'augmenter la résécabilité de la tumeur. Diverses sociétés savantes ont établi des recommandations de prise en charge, qui sont susceptibles d'évoluer[7]. Elles sont synthétisées dans le tableau suivant :
| Chirurgie | Radiothérapie | Chimiothérapie | |
|---|---|---|---|
| Stade I | oui, seule | non | non |
| Stade II | oui | néoadjuvante discutée, à réserver aux risques élevés de récidive locale | non |
| Stade III | oui | néoadjuvante associée à une chimiothérapie pour diminuer la taille tumorale en cas de doute sur la résécabilité ; adjuvante, en cas de résection incomplète |
adjuvante, en cas de résection incomplète |
| Stade IVa | oui, si résection complète possible | couplée à une chimiothérapie si pas de chirurgie possible | néoadjuvante |
| Stade IVb | non | non | oui, seule |
Si les thymomes sont, dans leur ensemble, bien chimiosensibles même aux stades avancés[7], les données actuelles de la science ne sont pas en faveur d'un traitement adjuvant à base de chimiothérapie seule. Dans les stades précoces (Masaoka I et II), la chirurgie demeure le traitement de référence et peut être complétée d'une radiothérapie adjuvante en cas de résection incomplète. Pour les stades plus avancés (Masaoka III et Iva et carcinomes thymiques), et de manière néoadjuvante, une radio-chimiothérapie adjuvante est préconisée, la chimiothérapie seule ne permettant pas de gain de survie[74].
Les chimiothérapies proposées sont fréquemment à base de cisplatine[98], qui inhibe la réplication et induit la mort cellulaire préférentielle des cellules cancéreuses.
Il n'existe pas de thérapie ciblée disponible pour les thymomes[99].
Il existe en France un réseau spécialisé, appelé RYTHMIC et instauré par l'INCa, dont le rôle est d'établir un référentiel national sur cette prise en charge, mais aussi de gérer une réunion de concertation pluridisciplinaire (RCP) nationale bimensuelle, d'informer les patients et d'encadrer la recherche[100].
Cas particulier des récidives locales modifier
Le taux de récidive des thymomes est compris entre 10 et 29 % après un premier traitement chirurgical, et la récidive survient souvent plusieurs années après l'intervention[101]. Les récidives locales constituent 5 % des modes de récidive, même après une résection chirurgicale complète, et concernent principalement les thymomes de stade III ou IV[102].
La prise en charge des récidives de thymomes est un sujet de débat sans consensus clair[103]. Le traitement des récidives locales peut être de nouveau chirurgical, ou à base de radiothérapie ou chimiothérapie. La chirurgie peut consister en une simple résection des lésions, ou s'associer à une chimiothérapie per opératoire dans le cadre d'une chimiothérapie hyperthermique intrapleurale (CHIT)[104]. Une méta-analyse réalisée en 2014 et portant sur 11 études[101] conclut à un pronostic à long terme plus favorable en cas de réopération, malgré le caractère souvent incomplet de la résection. Des réserves méthodologiques liées à l'absence d'essais randomisés et à la rareté de la maladie sont cependant émises. Lorsqu'une nouvelle intervention est impossible, une chimiothérapie seule est habituellement préconisée[7].
Pronostic et suivi modifier
Facteurs pronostiques modifier
Au moment du diagnostic, les patients présentent dans 40 % des cas une tumeur de stade I de Masaoaka, 25 % un stade II ou III, 10 % un stade IVa et seulement 1 à 2 % de stade IVb[10].
Le principal facteur pronostic est l'extension locale au moment du diagnostic, suivie de l'âge et de la qualité de la résection chirurgicale. En ce qui concerne le diagnostic histologique, les carcinomes thymiques sont de plus mauvais pronostic que les autres types de thymomes[51]. Le stade Masaoka et la nature histologique sont deux facteurs pronostiques indépendants l'un de l'autre[34]. La présence d'une myasthénie ou d'un syndrome paranéoplasique n'influence pas le pronostic[34]. En cas de récidive, le nombre de lésions apparues secondairement est un facteur pronostique[105].
Récidive et suivi modifier
Environ 90 % des récidives se font sous forme de métastases pleurales[106] ; l'apparition ou la réapparition d'une myasthénie doit faire évoquer une récidive[102]. Certains types histologiques sont plus à risque de récidive après traitement, les types A et AB récidivant dans 1 à 2 % des cas, contre 2 à 7 % pour les types B1, B2 et B3, sans différence de survie entre ces sous-types[51]. Le stade au moment du diagnostic est lui aussi un facteur prédictif de récidive[41].
En raison du caractère souvent tardif des récidives, certains préconisent un suivi régulier pendant 10 ans après le traitement initial afin de les dépister et les traiter précocement[102]. Le suivi recommandé consiste en un scanner thoracique annuel, avec également pour certains un suivi des marqueurs biologiques élevés au moment du diagnostic[107].
Pronostic modifier
La survie à cinq ans après résection chirurgicale est bonne, même pour les patients à des stades avancés de la maladie[18].
La survie globale à 15 ans est excellente aux stades précoces[10]. Elle est plus faible pour les stades plus avancés[108], mais ces patients n'ont pas toujours pu bénéficier d'une chirurgie optimale en raison de l'envahissement local[10]. La survie à long terme tend à augmenter depuis les années 1980, en raison d'un diagnostic plus précoce et de nouvelles techniques chirurgicales permettant d'obtenir une ablation complète de la tumeur[42]. La cause du décès des patients est liée au thymome dans 19 à 58 % des cas selon les séries, à une complication opératoire dans 2 à 19 % des cas, à l'évolution d'une myasthénie dans 16 à 27 % des cas, et dans 8 à 47 % des cas à des causes non liées au thymome ou à son traitement[10]. L'hétérogénéité de ces chiffres illustre la manière dont les traitements évoluent depuis la deuxième moitié du XXe siècle, rendant difficile le suivi de cohortes homogènes de patients à long terme[42]. Par ailleurs, comme exposé plus haut dans la description des difficultés d'établissement d'une classification internationale, il s'agit souvent de petites cohortes de patients assez hétérogènes[10].
La survie sans récidive est peut-être un meilleur outil de mesure de l'efficacité des traitements, car elle s'affranchit des causes de mortalité non liées au thymome et son traitement[10]. Elle est comparée à la survie globale dans le tableau ci-dessous.
| Survie globale à 15 ans | Survie sans récidive à 10 ans | |
|---|---|---|
| Stade I | 78 % | 92 % |
| Stade II | 73 % | 87 % |
| Stade III | 30 % | 60 % |
| Stade IV | 8 % | 35 % |
Notes et références modifier
Notes modifier
- Pour en savoir plus sur l’étymologie, voyez les articles suivants du Wiktionnaire : θυμός, thymus, -ome et thymome.
- Les cellules épithéliales et les cellules mésenchymateuses sont les types de cellules constitutives de deux grands types de tissus de l'organisme, respectivement les épithéliums et les tissus conjonctifs.
- « No group of tumors has more successfully resisted attempts at interpretation and classification than those of the thymus. The problems involved include those which have complicated the embryologic and histologic study of the gland, while added difficulties arise from the comparative rarity and considerable diversity of the tumors, and from the somewhat imperfect knowledge of the general pathology of the thymus. »
- Les classifications TNM sont basées sur trois critères : la taille de la tumeur (T), l'envahissement ganglionnaire (N) et la présence et la localisation des métastases (M).
- Les métastases extrapulmonaires sont très rares.
Références modifier
- (en) M. Nishino, S. K.Ashiku, O. N. Kocher, R. L. Thurer, P. M. Boisselle et H. Hatabu, « The Thymus: A Comprehensive Review », RadioGraphics, vol. 26, no 2, , p. 335-48 (DOI 10.1148/rg.262045213, lire en ligne, consulté le ).

- (en) Vincent Geenen, « The thymus in 2013: from a ‘vestigial’ organ to immunological self-tolerance and autoimmunity », Proceedings of the Belgian Royal Academies of Medicine, Bruxelles, Académie Royale de Médecine de Belgique., vol. 3, , p. 171-193 (ISSN 2034-7626, lire en ligne [PDF]).
 Du même auteur et sur le même thème, mais en français : résumé de l'article, conférence en 2013 sur youtube.
Du même auteur et sur le même thème, mais en français : résumé de l'article, conférence en 2013 sur youtube. - A. de Mascarel, M. Parrens, JF. Goussot et H. Bégueret, « Tumeurs du médiastin antérieur — Tumeurs épithéliales thymiques », sur Respir.com, (consulté le )
- « Qu’est-ce que le cancer du thymus ? », sur Société canadienne du cancer (consulté le ).
- « Le Thymus », sur Société canadienne du cancer (consulté le ).
- (en) P. Tosi, R. Kraft, P. Luzi, M. Cintorino, G. Fankhauser, M. W. Hess et H. Cottier, « Involution patterns of the human thymus. I Size of the cortical area as a function of age. », Clinical and experimental immunology, vol. 47, no 2, , p. 497-504 (PMID 7075032, lire en ligne, consulté le ).

- Fujii 2011.
- (en) Marius Raica, Anca Maria Cimpean et Domenico Ribatti, « Myasthenia gravis and the thymus gland. A historical review », Clinical and Experimental Medicine, Springer Science + Business Media, vol. 8, no 2, , p. 61-64 (ISSN 1591-8890, DOI 10.1007/s10238-008-0158-y, lire en ligne).

- (de) C. Weigert, « Pathologisch-anatomischer Beitrag zur Erb’schen Krankheit (Myasthenia gravis) », Neurologisches Centralblatt, no 20, , p. 597-601.
- Detterbeck & Parsons 2004.
- (en) H. Reid et R. Marcus, « Thymoma. With a report of 5 cases », British Journal of Surgery, vol. 36, no 143, , p. 271-279 (DOI 10.1002/bjs.1800361430, lire en ligne, consulté le ).

- « Nomenclature des tumeurs », sur Campus d'Anatomie Pathologique - Collège Français des Pathologistes (CoPath) (consulté le ).
- (en) Alfred Blalock, M. F. Mason, H. J. Morgan et S. S. Riven, « Myasthenia Gravis and Tumors of the Thymic Region - Report of a case in which the tumor was removed », Annals of Surgery, vol. 110, no 4, , p. 544-561 (PMCID PMC1391425, lire en ligne, consulté le ).

- Srirajaskanthan et coll 2008.
- (en) Annikka Weissferdt et Cesar A. Moran, « Staging of thymic epithelial neoplasms: Thymoma and thymic carcinoma », Pathology - Research and Practice, Elsevier BV, vol. 211, no 1, , p. 2-11 (ISSN 0344-0338, DOI 10.1016/j.prp.2014.06.007, lire en ligne).
- « Thymomes : le CHU de Lyon labellisé par l’INCA », sur Réseau CHU, (consulté le ).
- « Patients », sur Réseau tumeurs thymiques et cancer (RYTHMIC) (consulté le ).
- « Thymome », sur Orphanet, mis à jour : mars 2011 (consulté le ).
- (en) Annabelle L. Fonseca, Doruk E. Ozgediz, Emily R. Christison-Lagay, Frank C. Detterbeck et Michael G. Caty, « Pediatric thymomas: report of two cases and comprehensive review of the literature », Pediatr Surg Int, Springer Science + Business Media, vol. 30, no 3, , p. 275-286 (ISSN 0179-0358, DOI 10.1007/s00383-013-3438-x, lire en ligne).

- (en) J. Jaggers et K. Balsara, « Mediastinal masses in children », Seminars in thoracic and cardiovascular surgery, Elsevier, vol. 16, no 3, , p. 201-208 (PMID 15619186, lire en ligne, consulté le ).

- « Facteurs de risque des tumeurs du thymus », sur Société canadienne du cancer (consulté le ).
- (en) Frédéric Nicodème, Sandrine Geffroy, Massimo Conti, Bruno Delobel, Valérie Soenen, Nathalie Grardel, Henri Porte, Marie-Christine Copin, Jean-Luc Laï et Joris Andrieux, « Familial occurrence of thymoma and autoimmune diseases with the constitutional translocation t(14;20)(q24.1;p12.3) », Genes Chromosom. Cancer, Wiley-Blackwell, vol. 44, no 2, , p. 154-160 (ISSN 1045-2257, DOI 10.1002/gcc.20225, lire en ligne).
- (en) Roland Penzel, Josef Hoegel, Waltraud Schmitz, Hendrik Blaeker, Alicia Morresi-Hauf, Sebastian Aulmann, Erich Hecker, Gunhild Mechtersheimer, Herwart F. Otto et Ralf J. Rieker, « Clusters of chromosomal imbalances in thymic epithelial tumours are associated with the WHO classification and the staging system according to Masaoka », International Journal of Cancer, Wiley-Blackwell, vol. 105, no 4, , p. 494-498 (ISSN 0020-7136, DOI 10.1002/ijc.11101, lire en ligne).

- (en) Xinxin Zhang, Tao Wang, Wei Wang, Yibing Ding, Lixing Zhou, Qiuyan Chen, Xiang Gao, Yongzheng Wu, Yuna Mei, Yu Jin, Qian Gao et Long Yi, « Does familial breast cancer and thymoma suggest a cancer syndrome? A family perspective », Gene, Elsevier BV, vol. 573, no 2, , p. 333-337 (ISSN 0378-1119, DOI 10.13039/501100002949, lire en ligne).

- (en) Biao Liu, Qiu Rao, Yun Zhu, Bo Yu, Hai-yan Zhu et Xiao-jun Zhou, « Metaplastic Thymoma of the Mediastinum », American Journal of Clinical Pathology, Oxford University Press (OUP), vol. 137, no 2, , p. 261-269 (ISSN 0002-9173, DOI 10.1309/ajcp0t1jfylmphmi, lire en ligne).

- (en) Manuel López-Cano, José M Ponseti-Bosch, Eloi Espin-Basany, José L Sánchez-García et Manuel Armengol-Carrasco, « Clinical and pathologic predictors of outcome in Thymoma-Associated myasthenia gravis », The Annals of Thoracic Surgery, Elsevier BV, vol. 76, no 5, , p. 1643-1649 (ISSN 0003-4975, DOI 10.1016/s0003-4975(03)01139-1, lire en ligne).

- (en) Yoshitaka Fujii, « The thymus, thymoma and myasthenia gravis », Surgery Today, Springer, vol. 43, no 5, , p. 461-466 (DOI 10.1007/s00595-012-0318-2, lire en ligne, consulté le ).

- Marom 2010.
- (en) Carlos S. Restrepo, Meenakshi Pandit, Isabel C. Rojas, Miguel A. Villamil, Hernan Gordillo, Diego Lemos, Luciano Mastrogiovanni et Lisa Diethelm, « Imaging findings of expansile lesions of the thymus », Current Problems in Diagnostic Radiology, Elsevier BV, vol. 34, no 1, , p. 22-34 (ISSN 0363-0188, DOI 10.1067/j.cpradiol.2004.10.001, lire en ligne).

- (en) Erin M. Casey, Patrick J. Kiel et Patrick J. Loehrer, « Clinical Management of Thymoma Patients », Hematology\/Oncology Clinics of North America, Elsevier BV, vol. 22, no 3, , p. 457-473 (ISSN 0889-8588, DOI 10.1016/j.hoc.2008.03.010, lire en ligne).

- Wright 2008.
- (en) Noriyuki Tomiyama, Nestor L. Müller, Samantha J. Ellis, Joanne R. Cleverley, Meinoshin Okumura, Shinichiro Myoshi, Masahiko Kusumoto, Takeshi Johkoh, Shigeyuki Yoshida, Naoki Mihara, Osamu Honda, Takenori Kozuka, Seiki Hamada et Hironobu Nakamura, « Invasive and noninvasive thymoma: distinctive CT features », Journal of computed assisted tomography, Lippincott Williams & Wilkins, Inc, vol. 25, no 3, , p. 388-393 (PMID 11351188, lire en ligne, consulté le ).

- (en) Elena Scagliori, Laura Evangelista, Analori Panunzio, Fiorella Calabrese, Nasarena Nannini, Roberta Polverosi et Fabio Pomerri, « Conflicting or complementary role of computed tomography (CT) and positron emission tomography (PET)/CT in the assessment of thymic cancer and thymoma: our experience and literature review », Thoracic Cancer, Wiley-Blackwell, vol. 6, no 4, , p. 433-442 (DOI 10.1111/1759-7714.12197, lire en ligne, consulté le ).

- (en) Meinoshin Okumura, Shinichiro Miyoshi, Yoshitaka Fujii, Yukiyasu Takeuchi, Hiroyuki Shiono, Masayoshi Inoue, Kenjirou Fukuhara, Yoshihisa Kadota, Hisashi Tateyama, Tadaaki Eimoto et Hikaru Matsuda, « Clinical and Functional Significance of WHO Classification on Human Thymic Epithelial Neoplasms », The American Journal of Surgical Pathology, Ovid Technologies (Wolters Kluwer Health), vol. 25, no 1, , p. 103-110 (ISSN 0147-5185, DOI 10.1097/00000478-200101000-00012, lire en ligne).
- (en) R. A. Good, « Agammaglobulinaemia—a provocative experiment of nature », Bulletin of the University of Minnesota, vol. 26, , p. 1-19.
- (en) Mark Henry Joven, Melvin P. Palalay et Charlie Y Sonido, « Case report and literature review on Good's syndrome, a form of acquired immunodeficiency associated with thymomas. », Hawai'i Journal of Medicine & Public Health, University Clinical, Education & Research Associates (UCERA), vol. 72, no 2, , p. 56-62 (ISSN 2165-8218, PMID 23467629, lire en ligne, consulté le ).

- (en) Fred S. Rosen, Martha Eibl, Chaim Roifman, Alain Fischer, John Volanakis, Fernando Aiuti, Luigi Notarangelo, Tadamitsu Kishimoto, Igor B. Resnick, Lennart Hammarstrom, Reinhard Seger, Helen Chapel, Max D. Cooper, Raif S. Geha, Robert A. Good, Thomas A. Waldmann et Ralph J.P. Wedgwood, « Primary Immunodeficiency Diseases Report of an IUIS Scientific Committee », Clinical and Experimental Immunology, Wiley-Blackwell, vol. 118, no S1, , p. 1-28 (ISSN 0009-9104, DOI 10.1046/j.1365-2249.1999.00109.x, lire en ligne).
- (en) P. Kelleher, « What is Good's syndrome? Immunological abnormalities in patients with thymoma », Journal of Clinical Pathology, BMJ, vol. 56, no 1, , p. 12-16 (ISSN 0021-9746, DOI 10.1136/jcp.56.1.12, lire en ligne).
- (en) James Huang, Usman Ahmad, Alberto Antonicelli, Ann Christine Catlin, Wentao Fang, Daniel Gomez, Patrick Loehrer, Marco Lucchi, Edith Marom, Andrew Nicholson, Enrico Ruffini, William Travis, Paul Van Schil, Heather Wakelee, Xiaopan Yao et Frank Detterbeck, « Development of the International Thymic Malignancy Interest Group International Database: An Unprecedented Resource for the Study of a Rare Group of Tumors », Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 10, , p. 1573-1578 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000269, lire en ligne).
- (en) Amelia Evoli et Eric Lancaster, « Paraneoplastic Disorders in Thymoma Patients », Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 9, , S143-S147 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000300, lire en ligne).
- (en) David Blumberg, Jeffrey L. Port, Benny Weksler, Ruby Delgado, Juan Rosai, Manjit S. Bains, Robert J. Ginsberg, Nael Martini, Patricia M. McCormack, Valerie Rusch et Micahel E. Burt, « Thymoma: A multivariate analysis of factors predicting survival », The Annals of Thoracic Surgery, Elsevier BV, vol. 60, no 4, , p. 908-914 (ISSN 0003-4975, DOI 10.1016/0003-4975(95)00669-c, lire en ligne).
- (en) Katrina H. Moore, Paul R. McKenzie, Catherine W. Kennedy et Brian C. McCaughan, « Thymoma: trends over time », The Annals of Thoracic Surgery, Elsevier BV, vol. 72, no 1, , p. 203-207 (ISSN 0003-4975, DOI 10.1016/s0003-4975(01)02633-9, lire en ligne).
- (en) James Ewing, Neoplastic diseases : a treatise on tumors, Philadelphia ; London, W.B.Saunders, , 2e éd. (1re éd. 1916), 1053 p. (lire en ligne), chap. XLVI (« The thymus and its tumors »), p. 912.
- (en) Frank Detterbeck et Robert Korst, « The International Thymic Malignancy Interest Group Thymic Initiative: A State-of-the-Art Study of Thymic Malignancies », Seminars in Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 26, no 4, , p. 317-322 (ISSN 1043-0679, DOI 10.1053/j.semtcvs.2015.02.002, présentation en ligne).
- (en) Michael A. den Bakker, Alexander Marx, Kiyoshi Mukai et Philipp Ströbel, « Mesenchymal tumours of the mediastinum - part I », Virchows Archiv, Springer Science + Business Media, vol. 467, no 5, , p. 487-500 (ISSN 0945-6317, DOI 10.1007/s00428-015-1830-8, lire en ligne).
- Marx et coll 2015.
- (en) Travis, W.D., Brambilla, E., Burke, A.P., Marx, A. et Nicholson, A. G., WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Fourth edition, Lyon, International agency for research on cancer, , 412 p. (ISBN 978-92-832-2436-5, lire en ligne).
- « Tumeurs malignes du thymus », sur Société canadienne du cancer (consulté le ).
- (en) Juan Rosai et Enrique Higa, « Mediastinal endocrine neoplasm, of probable thymic origin, related to carcinoid tumor. Clinicopathologic study of 8 cases », Cancer, American Cancer Society, vol. 29, no 4, , p. 1061-1074 (ISSN 1097-0142, lire en ligne, consulté le ).
- (en) Meinoshin Okumura, Hiroyuki Shiono, Masato Minami, Masayoshi Inoue, Tomoki Utsumi, Yoshihisa Kadota et Yoshiki Sawa, « Clinical and pathological aspects of thymic epithelial tumors », General Thoracic and Cardiovascular Surgery, Springer Science + Business Media, vol. 56, no 1, , p. 10-16 (ISSN 1863-6705, DOI 10.1007/s11748-007-0177-8, lire en ligne).
- (en) Cleo-Aron Weis, Xiaopan Yao, Yanhong Deng, Frank C. Detterbeck, Mirella Marino, Andrew G. Nicholson, James Huang, Philipp Ströbel, Alberto Antonicelli et Alexander Marx, « The Impact of Thymoma Histotype on Prognosis in a Worldwide Database », Journal of Thoracic Oncology, Elsevier BV, vol. 10, no 2, , p. 367-372 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000393, lire en ligne).
- (en) Borislav A. Alexiev, Cinthia B. Drachenberg et Allen P. Burke, « Thymomas: a cytological and immunohistochemical study, with emphasis on lymphoid and neuroendocrine markers », Diagnostic Pathology, BioMed Central Ltd., vol. 11, , p. 2-13 (ISSN 1746-1596, DOI 10.1186/1746-1596-2-13, lire en ligne, consulté le ).
- « Stadification », sur Société canadienne du cancer (consulté le ).
- (en) Akira Masaoka, « Staging System of Thymoma », Journal of Thoracic Oncology, Elsevier BV, vol. 5, no 10, , S304-S312 (ISSN 1556-0864, DOI 10.1097/jto.0b013e3181f20c05, lire en ligne).
- (en) Sandra Tomaszek, Dennis A. Wigle, Shaf Keshavjee et Stefan Fischer, « Thymomas: Review of Current Clinical Practice », The Annals of Thoracic Surgery, Elsevier BV, vol. 87, no 6, , p. 1973-1980 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2008.12.095, lire en ligne).
- (en) Pier Luigi Filosso, Enrico Ruffini, Paolo Olivo Lausi, Marco Lucchi, Alberto Oliaro et Frank Detterbeck, « Historical perspectives: The evolution of the thymic epithelial tumors staging system », Lung Cancer, Elsevier BV, vol. 83, no 2, , p. 126-132 (ISSN 0169-5002, DOI 10.1016/j.lungcan.2013.09.013, lire en ligne).
- (en) N.P. Bergh, P. Gatzinsky, S. Larsson, P. Lundin et B. Ridell, « Tumors of the Thymus and Thymic Region: I. Clinicopathological Studies on Thymomas », The Annals of Thoracic Surgery, Elsevier BV, vol. 25, no 2, , p. 91-98 (ISSN 0003-4975, DOI 10.1016/s0003-4975(10)63498-4, lire en ligne).
- (en) Earle W. Wilkins et Benjamin Castleman, « Thymoma: A Continuing Survey at the Massachusetts General Hospital », The Annals of Thoracic Surgery, Elsevier BV, vol. 28, no 3, , p. 252-256 (ISSN 0003-4975, DOI 10.1016/s0003-4975(10)63114-1, lire en ligne).
- (en) Akira Masaoka, Yasumasa Monden, Kazuya Nakahara et Tsuneo Tanioka, « Follow-up study of thymomas with special reference to their clinical stages », Cancer, American Cancer Society, vol. 48, no 11, , p. 2485-2492 (ISSN 1097-0142, lire en ligne, consulté le ).
- Koga et coll 1994.
- (en) Frank C. Detterbeck, Andrew G. Nicholson, Kazuya Kondo, Paul Van Schil et Cesar Moran, « The Masaoka-Koga Stage Classification for Thymic Malignancies: Clarification and Definition of Terms », Journal of Thoracic Oncology, Elsevier BV, vol. 6, no 7, , S1710-S1716 (ISSN 1556-0864, DOI 10.1097/jto.0b013e31821e8cff, lire en ligne).
- (en) Cesar A. Moran, Garrett Walsh, Saul Suster et Larry Kaiser, « Thymomas II », American Journal of Clinical Pathology, Oxford University Press (OUP), vol. 137, no 3, , p. 451-461 (ISSN 0002-9173, DOI 10.1309/ajcp36alguzwosea, lire en ligne).
- (en) Colin B. Begg, Laura D. Cramer, E. S. Venkatraman et Juan Rosai, « Comparing tumour staging and grading systems: a case study and a review of the issues, using thymoma as a model », Statistics in Medicine, vol. 19, no 15, , p. 1997-2014 (ISSN 1097-0258, lire en ligne, consulté le ).
- (en) Ryosuke Tsuchiya, Kenji Koga, Yoshihiro Matsuno, Kiyoshi Mukai et Yukio Shimosato, « Thymic carcinoma: proposal for pathological TNM and staging », Pathology International, Japanese Society of Pathology and John Wiley & Sons Australia, Ltd, vol. 44, no 7, , p. 502-512 (ISSN 1440-1827, lire en ligne, consulté le ).
- (en) Annikka Weissferdt et Cesar A. Moran, « Thymic Carcinoma, Part 1 : A Clinicopathologic and Immunohistochemical Study of 65 Cases », American Journal of Clinical Pathology, Oxford University Press, vol. 138, no 1, , p. 103-114 (DOI 10.1309/AJCP88FZTWANLRCB, lire en ligne).
- Kondo et coll 2014.
- (en) Yosuke Yamakawa, Akira Masaoka, Takahiko Hashimoto, Hiroshi Niwa, Tsutomu Mizuno, Yoshitaka Fujii et Kazuya Nakahara, « A tentative tumor–node–metastasis classification of thymoma », Cancer, American Cancer Society, vol. 68, no 9, , p. 1984-1987 (ISSN 1097-0142, lire en ligne, consulté le ).
- (en) Amedeo Vittorio Bedini, Stefano Michele Andreani, Luca Tavecchio, Alessandra Fabbri, Roberto Giardini, Tiziana Camerini, Rosaria Bufalino, Alberto Morabito et Juan Rosai, « Proposal of a Novel System for the Staging of Thymic Epithelial Tumors », The Annals of Thoracic Surgery, Elsevier BV, vol. 80, no 6, , p. 1994-2000 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2005.07.019, lire en ligne).
- Detterbeck et coll 2014.
- (en) Richard F. Riedel et William R. Burfeind, Jr., « Thymoma: Benign Appearance, Malignant Potential », The Oncologist, Alphamed Press, vol. 11, no 8, , p. 887-894 (ISSN 1083-7159, DOI 10.1634/theoncologist.11-8-887, lire en ligne).
- (en) Guiliano Maggi, Caterina Casadio, Antonio Cavallo, Roberto Cianci, Massimo Molinatti et Enrico Ruffini, « Thymoma: results of 241 operated cases », The Annals of Thoracic Surgery, Elsevier BV, vol. 51, no 1, , p. 152-156 (ISSN 0003-4975, DOI 10.1016/0003-4975(91)90478-9, lire en ligne, consulté le ).
- (en) K. Nakahara, K. Ohno, J. Hashimoto, H. Maeda, S. Miyoshi, Sakurai M, Monden Y et Kawashima Y, « Thymoma: results with complete resection and adjuvant postoperative irradiation in 141 consecutive patients », The Journal of Thoracic and Cardiovascular Surgery, Elsevier, vol. 95, no 6, , p. 1041-1047 (ISSN 0022-5223, PMID 3374155, lire en ligne, consulté le ).
- (en) Federico Venuta, Erino A Rendina, Edoardo O Pescarmona, Tiziano De Giacomo, Maria Luce Vegna, Paola Fazi, Isac Flaishman, Enrico Guarino et Costante Ricci, « Multimodality Treatment of Thymoma: A Prospective Study », The Annals of Thoracic Surgery, Elsevier BV, vol. 64, no 6, , p. 1585-1592 (ISSN 0003-4975, DOI 10.1016/s0003-4975(97)00629-2, lire en ligne).
- (en) Saina Attaran, David McCormack, John Pilling et Karen Harrison-Phipps, « Which stages of thymoma benefit from adjuvant chemotherapy post-thymectomy? », Interactive CardioVascular and Thoracic Surgery, Oxford University Press (OUP), vol. 15, no 2, , p. 273-275 (ISSN 1569-9293, DOI 10.1093/icvts/ivs133, lire en ligne).
- (en) M. Hamaji, F. Kojima, M. Omasa, T. Sozu, T. Sato, F. Chen, M. Sonobe et H. Date, « A meta-analysis of debulking surgery versus surgical biopsy for unresectable thymoma », European Journal of Cardio-Thoracic Surgery, Oxford University Press (OUP), vol. 47, no 4, , p. 602-607 (ISSN 1010-7940, DOI 10.1093/ejcts/ezu277, lire en ligne).
- (en) Jens Rueckert, Marc Swierzy, Harun Badakhshi, Andreas Meisel et Mahmoud Ismail, « Robotic-assisted thymectomy: surgical procedure and results », The Journal of Thoracic and Cardiovascular Surgery, Thieme, vol. 63, no 3, , p. 194-200 (ISSN 0171-6425, DOI 10.1055/s-0035-1549007, lire en ligne, consulté le ).
- (en) Alper Toker, « Standardized definitions and policies of minimally invasive thymoma resection », Annals of Cardiothoracic Surgery, AME Publishing Company, vol. 4, no 6, , p. 535-539 (ISSN 2225-319X, PMCID 4669255, DOI 10.3978/j.issn.2225-319X.2015.10.02, lire en ligne, consulté le ).
- (en) Joseph B. Shrager, « Extended Transcervical Thymectomy: The Ultimate Minimally Invasive Approach », The Annals of Thoracic Surgery, Elsevier BV, vol. 89, no 6, , S2128-S2134 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2010.02.099, lire en ligne).
- (en) Marcin Zieliński, Jaros Kuzdzał J et Artur Szlubowski, « Transcervical-subxiphoid-videothoracoscopic "maximal" thymectomy--operative technique and early results », The Annals of Thoracic Surgery, Elsevier BV, vol. 78, no 2, , p. 404-409 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2004.02.021, lire en ligne).
- (en) N. Kitagawa, M. Shinkai, H. Take, K. Mochizuki, F. Asano, H. Usui, H. Miyagi, T. Kido, N. Kurauchi, H. Osaka et S. Yamashita, « Mediastinoscopic extended thymectomy for pediatric patients with myasthenia gravis », Journal of Pediatric Surgery, Elsevier Inc., vol. 50, no 4, , p. 528-530 (ISSN 0022-3468, PMID 25840056, lire en ligne, consulté le ).
- Hess et coll 2016.
- Maurizi et coll 2015.
- (en) I. Zahid, S. Sharif, T. Routledge et M. Scarci, « Video-assisted thoracoscopic surgery or transsternal thymectomy in the treatment of myasthenia gravis? », Interactive CardioVascular and Thoracic Surgery, Oxford University Press (OUP), vol. 12, no 1, , p. 40-46 (ISSN 1569-9293, DOI 10.1510/icvts.2010.251041, lire en ligne).
- (en) Pio Maniscalco, Nicola Tamburini, Francesco Quarantotto, William Grossi, Elena Garelli et Giorgio Cavallesco, « Long-Term Outcome for Early Stage Thymoma: Comparison between Thoracoscopic and Open Approaches », The Thoracic and Cardiovascular Surgeon, Thieme Publishing Group, vol. 63, no 03, , p. 201-205 (ISSN 0171-6425, DOI 10.1055/s-0034-1396594, lire en ligne, consulté le ).
- (en) René Horsleben Petersen, « Video-assisted thoracoscopic thymectomy using 5-mm ports and carbon dioxide insufflation », Annals of Cardiothoracic Surgery, AME Publishing Group, vol. 5, no 1, , p. 51-55 (ISSN 2225-319X, DOI 10.3978/j.issn.2225-319X.2016.01.02, lire en ligne, consulté le ).
- (en) Kazuo Nakagawa, Kohei Yokoi, Jun Nakajima, Fumihiro Tanaka, Yoshimasa Maniwa, Makoto Suzuki, Takeshi Nagayasu et Hisao Asamura, « Is Thymomectomy Alone Appropriate for Stage I (T1N0M0) Thymoma? Results of a Propensity-Score Analysis », The Annals of Thoracic Surgery, Elsevier BV, vol. 101, no 2, , p. 520-526 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2015.07.084, lire en ligne).
- (en) Faiz Y Bhora, David J Chen, Frank C Detterbeck, Hisao Asamura, Conrad Falkson, Pier Luigi Filosso, Giuseppe Giaccone, James Huang, Jhingook Kim, Kazuya Kondo, Marco Lucchi, Mirella Marino, Edith M Marom, Andrew G Nicholson, Meinoshin Okumura, Enrico Ruffini et Paul Van Schil, « The ITMIG\/IASLC Thymic Epithelial Tumors Staging Project: A Proposed Lymph Node Map for Thymic Epithelial Tumors in the Forthcoming 8th Edition of the TNM Classification of Malignant Tumors », Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 9, , S88-S96 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000293, lire en ligne).
- (en) Andrea Viti, Luca Bertolaccini et Alberto Terzi, « What is the role of lymph nodal metastases and lymphadenectomy in the surgical treatment and prognosis of thymic carcinomas and carcinoids? », Interact CardioVasc Thorac Surg, Oxford University Press (OUP), vol. 19, no 6, , p. 1054-1058 (ISSN 1569-9293, DOI 10.1093/icvts/ivu281, lire en ligne).
- (en) Benny Weksler, Arjun Pennathur, Jennifer L. Sullivan et Katie S. Nason, « Resection of thymoma should include nodal sampling », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 149, no 3, , p. 737-742 (ISSN 0022-5223, DOI 10.1016/j.jtcvs.2014.11.054, lire en ligne).
- Kadota et coll 2015.
- (en) G. O. Skeie, S. Apostolski, A. Evoli, N. E. Gilhus, I. Illa, L. Harms, D. Hilton-Jones, A. Melms, J. Verschuuren et H. W. Horge, « Guidelines for treatment of autoimmune neuromuscular transmission disorders », European Journal of Neurology, Wiley-Blackwell, vol. 17, no 7, , p. 893-902 (ISSN 1351-5101, DOI 10.1111/j.1468-1331.2010.03019.x, lire en ligne).
- (en) Yoshito Yamada, Shigetoshi Yoshida, Takekazu Iwata, Hidemi Suzuki, Tetsuzo Tagawa, Teruaki Mizobuchi, Naoki Kawaguchi et Ichiro Yoshino, « Risk Factors for Developing Postthymectomy Myasthenia Gravis in Thymoma Patients », The Annals of Thoracic Surgery, Elsevier BV, vol. 99, no 3, , p. 1013-1019 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2014.10.068, lire en ligne).
- (en) K. H. Choi, T. S. Nam, S. H. Lee et M. K. Kim, « Preoperative pulmonary function is strongly related to myasthenic crisis after thymectomy », Neurology India, vol. 62, no 2, , p. 164-168 (lire en ligne, consulté le ).
- (en) D. S. Younger et N. Raksadawan, « Medical therapies in myasthenia gravis », Chest Surgery Clinics of North America, W.B. Saunders Co., vol. 11, no 2, , p. 329-336 (ISSN 1547-4127, PMID 11413759, lire en ligne, consulté le ).
- (en) Peter E. Krucylak et Keith S. Naunheim, « Preoperative Preparation and Anesthetic Management of Patients With Myasthenia Gravis », Seminars in Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 11, no 1, , p. 47-53 (ISSN 1043-0679, DOI 10.1016/s1043-0679(99)70019-5, lire en ligne).
- (en) Shunsuke Endo, Tsutomu Yamaguchi, Noriko Saito, Shinichi Otani, Tsuyoshi Hasegawa, Yukio Sato et Yasunori Sohara, « Experience with programmed steroid treatment with thymectomy in nonthymomatous myasthenia gravis », The Annals of Thoracic Surgery, Elsevier BV, vol. 77, no 5, , p. 1745-1750 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2003.10.039, lire en ligne).
- (en) Edward Arsura, Norman G. Brunner, Tatsuji Namba et David Grob, « High-Dose Intravenous Methylprednisolone in Myasthenia Gravis », Archives of Neurology, American Medical Association (AMA), vol. 42, no 12, , p. 1149-1153 (ISSN 0003-9942, DOI 10.1001/archneur.1985.04060110031011, lire en ligne).
- Wei 2013.
- (en) R. J. Kelly, I. Petrini, A. Rajan, Y. Wang et G. Giaccone, « Thymic Malignancies: From Clinical Management to Targeted Therapies », Journal of Clinical Oncology, American Society of Clinical Oncology (ASCO), vol. 29, no 36, , p. 4820-4827 (ISSN 0732-183X, DOI 10.1200/jco.2011.36.0487, lire en ligne)
- « Réseau tumeurs thymiques et cancer » (consulté le ).
- (en) Masatsugu Hamaji, Syed Osman Ali et Bryan M. Burt, « A Meta-Analysis of Surgical Versus Nonsurgical Management of Recurrent Thymoma », The Annals of Thoracic Surgery, Elsevier BV, vol. 98, no 2, , p. 748-755 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2014.04.028, lire en ligne).
- (en) Masayuki Haniuda, Ryoichi Kondo, Hiroki Numanami, Akiko Makiuchi, Emi Machida et Jun Amano, « Recurrence of thymoma: Clinicopathological features, re-operation, and outcome », Journal of Surgical Oncology, Wiley-Blackwell, vol. 78, no 3, , p. 183-188 (ISSN 0022-4790, DOI 10.1002/jso.1146, lire en ligne).
- (en) Alberto Sandri, Giacomo Cusumano, Filippo Lococo, Marco Alifano, Pierluigi Granone, Stefano Margaritora, Alfredo Cesario, Alberto Oliaro, Pierluigi Filosso, Jean-Francois Regnard et Enrico Ruffini, « Long-Term Results after Treatment for Recurrent Thymoma: A Multicenter Analysis », Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 12, , p. 1796-1804 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000370, lire en ligne).
- (en) Mark Shapiro et Robert J. Korst, « Surgical Approaches for Stage IVA Thymic Epithelial Tumors », Frontiers in Oncology, vol. 3, (ISSN 2234-943X, PMID 24459636, PMCID PMC3891210, DOI 10.3389/fonc.2013.00332, lire en ligne, consulté le )
- (en) Motoki Yano, Hidefumi Sasaki, Satoru Moriyama, Yu Hikosaka, Keisuke Yokota, Akira Masaoka et Yoshitaka Fujii, « Number of recurrent lesions is a prognostic factor in recurrent thymoma », Interact CardioVasc Thorac Surg, Oxford University Press (OUP), vol. 13, no 1, , p. 21-24 (ISSN 1569-9293, DOI 10.1510/icvts.2010.264036, lire en ligne).
- « Si le cancer du thymus se propage », sur Société canadienne du cancer (consulté le ).
- (en) Paul M. Claiborne, Clara S. Fowler et Ara A. Vaporciyan, « Follow-up of Patients with Resected Thoracic Malignancies », Thoracic Surgery Clinics, Elsevier BV, vol. 22, no 1, , p. 123-131 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2011.08.011, lire en ligne).
- (en) Jean-François Regnard, Pierre Magdeleinat, Christian Dromer, Elisabeth Dulmet, Vincent de Montpreville, Jean-François Levi et Philippe Levasseur, « Prognostic factors and long-term results after thymoma resection: a series of 307 patients », The Journal of Thoracic and Cardiovascular Surgery, Elsevier BV, vol. 112, no 2, , p. 376-384 (ISSN 0022-5223, PMID 8751506, DOI 10.1016/S0022-5223(96)70265-9, lire en ligne, consulté le ).
Voir aussi modifier
Principaux articles scientifiques utilisés modifier
Articles généraux modifier
- (en) Frank C Detterbeck et Alden M Parsons, « Thymic tumors » [« Tumeurs thymiques »], The Annals of Thoracic Surgery, Elsevier BV, vol. 77, no 5, , p. 1860-1869 (ISSN 0003-4975, DOI 10.1016/j.athoracsur.2003.10.001, lire en ligne).

- (en) R. Srirajaskanthan, C. Toubanakis, M. Dusmet et M.E. Caplin, « A review of thymic tumours » [« Une revue des tumeurs thymiques »], Lung Cancer, Elsevier BV, vol. 60, no 1, , p. 4-13 (ISSN 0169-5002, DOI 10.1016/j.lungcan.2008.01.014, lire en ligne).

- (en) Cameron D. Wright, « Management of thymomas » [« Prise en charge des thymomes »], Critical Reviews in Oncology/Hematology, Elsevier BV, vol. 65, no 2, , p. 109-120 (ISSN 1040-8428, DOI 10.1016/j.critrevonc.2007.04.005, lire en ligne).

Diagnostic et stadification modifier
- (en) Frank C. Detterbeck, Kelly Stratton, Dorothy Giroux, Hisao Asamura, John Crowley, Conrad Falkson, Pier Luigi Filosso, Aletta A. Frazier, Giuseppe Giaccone, James Huang, Jhingook Kim, Kazuya Kondo, Marco Lucchi, Mirella Marino, Edith M. Marom, Andrew G. Nicholson, Meinoshin Okumura, Enrico Ruffini et Paul Van Schil, « The IASLC/ITMIG Thymic Epithelial Tumors Staging Project: Proposal for an Evidence-Based Stage Classification System for the Forthcoming (8th) Edition of the TNM Classification of Malignant Tumors » [« Projet de stadification des tumeurs épithéliales thymiques de l'IASLC/ITMIG : proposition pour une classification des stades basée sur des preuves pour la huitième classification TNM des tumeurs malignes »], Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 9, , S65-S72 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000290, lire en ligne).

- (en) Kenji Koga, Yoshihiro Matsuno, Masayuki Noguchi, Kiyoshi Mukai, Hisao Asamura, Tomoyuki Goya et Yukio Shimosato, « A review of 79 thymomas: Modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma » [« Revue de 79 thymomes : modifications du système de stadification et réévalulation de la séparation conventionnelle en thymomes invasifs et non invasifs. »], Pathology International, Wiley-Blackwell, vol. 44, no 5, , p. 359-367 (ISSN 1320-5463, DOI 10.1111/j.1440-1827.1994.tb02936.x, lire en ligne).

- (en) Kazuya Kondo, Paul Van Schil, Frank C. Detterbeck, Meinoshin Okumura, Kelly Stratton, Dorothy Giroux, Hisao Asamura, John Crowley, Conrad Falkson, Pier Luigi Filosso, Giuseppe Giaccone, James Huang, Jhingook Kim, Marco Lucchi, Mirella Marino, Edith M Marom, Andrew G. Nicholson et Enrico Ruffini, « The IASLC/ITMIG Thymic Epithelial Tumors Staging Project: Proposals for the N and M Components for the Forthcoming (8th) Edition of the TNM Classification of Malignant Tumors » [« Projet de stadification des tumeurs épithéliales thymiques de l'IASLC/ITMIG : propositions pour les composants N et M pour la huitième édition de la classification TNM des tumeurs malignes »], Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 9, , S81-S87 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000291, lire en ligne).

- (en) Edith M. Marom, « Imaging Thymoma » [« Imagerie des thymomes »], Journal of Thoracic Oncology, Elsevier BV, vol. 5, no 10, , S296-S303 (ISSN 1556-0864, DOI 10.1097/jto.0b013e3181f209ca, lire en ligne).

- (en) Alexander Marx, Philipp Ströbel, Sunil S. Badve, Lara Chalabreysse, John K.C. Chan, Gang Chen, Laurence de Leval, Frank Detterbeck, Nicolas Girard, Jim Huang, Michael O. Kurrer, Libero Lauriola, Mirella Marino, Yoshihiro Matsuno, Thierry Jo Molina, Kiyoshi Mukai, Andrew G. Nicholson, Daisuke Nonaka, Ralf Rieker, Juan Rosai, Enrico Ruffini et William D. Travis, « ITMIG Consensus Statement on the Use of the WHO Histological Classification of Thymoma and Thymic Carcinoma: Refined Definitions, Histological Criteria, and Reporting » [« Déclaration de consensus de l'ITMIG sur l'utilisation de la classification de l'OMS pour les thymomes et carcinomes thymiques : définitions, critères histologiques et déclaration révisées »], Journal of Thoracic Oncology, Elsevier BV, vol. 9, no 5, , p. 596-611 (ISSN 1556-0864, DOI 10.1097/jto.0000000000000154, lire en ligne).

Recommandations modifier
- (en) Yoshitaka Fujii, « Published Guidelines for Management of Thymoma » [« Recommandations publiées pour la prise en charge des thymomes »], Thoracic Surgery Clinics, Elsevier BV, vol. 21, no 1, , p. 125-129 (ISSN 1547-4127, DOI 10.1016/j.thorsurg.2010.08.002, lire en ligne).

- « Référentiel du réseau RYTHMIC - Tumeurs épithéliales thymiques », sur Réseau tumeurs thymiques et cancer, (consulté le ).
Traitement modifier
- (en) Nicholas R. Hess, Inderpal S. Sarkaria, Arjun Pennathur, Ryan M. Levy, Neil A. Christie, James D. Luketich, « Minimally invasive versus open thymectomy: a systematic review of surgical techniques, patient demographics, and perioperative outcomes » [« Thymectomie mini-invasive ou ouverte : revue systématique des techniques chirurgicales, de la démographie des patients et des résultats périopératoires »], Annals of Cardiothoracic Surgery, vol. 5, no 1, , p. 1-9 (DOI 10.3978/j.issn.2225-319X.2016.01.01, lire en ligne).

- (en) Yoshihisa Kadota, Hirotoshi Horio, Takeshi Mori, Noriyoshi Sawabata, Taichiro Goto, Shinichi Yamashita, Takeshi Nagayasu et Akinori Iwasaki, « Perioperative management in myasthenia gravis: republication of a systematic review and a proposal by the guideline committee of the Japanese Association for Chest Surgery » [« Prise en charge périopératoire de la myasthénie : republication d'une revue systématique de la littérature et proposition du comité des bonnes pratiques de l'Association Japonaise de Chirurgie Thoracique »], General Thoracic and Cardiovascular Surgery, Springer, vol. 63, no 4, , p. 201-215 (DOI 10.1007/s11748-015-0518-y, lire en ligne).

- (en) Giulio Maurizi, Antonio D'Andrilli, Lorenzo Sommella, Federico Venuta et Erino A. Rendina, « Transsternal Thymectomy » [« Thymectomie trans-sternale »], The Journal of Thoracic and Cardiovascular Surgery, Thieme, vol. 63, no 3, , p. 178-186 (DOI 10.1055/s-0034-1396083, lire en ligne).

- (en) Mao Ling Wei, Deying Kang, Lijia Gu, Meng Qiu, Liao Zhengyin et Yanming Mu, « Chemotherapy for thymic carcinoma and advanced thymoma in adults » [« Chimiothérapie pour les carcinomes thymiques et thymomes localement avancés chez l'adulte »], Cochrane Database of Systematic Reviews, Wiley-Blackwell, (DOI 10.1002/14651858.cd008588.pub2, lire en ligne).

Liens externes modifier
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- « Réseau tumeurs thymiques et cancer (RYTHMIC) » (consulté le ).
- « Thymome », sur Orphanet, mis à jour : mars 2011 (consulté le ).
- « Qu’est-ce que le cancer du thymus ? », sur Société canadienne du cancer (consulté le ).
- « Tumeurs épithéliales du thymus et thymomes », fiche d’information patient, sur Institut mutualiste Montsouris, mis à jour : (consulté le ).
- « La thymectomie », sur Association des Myasthéniques Isolés et Solidaires, (consulté le ).