Wikipédia:Sélection/Chimie
Acétone L’acétone (aussi connue sous les noms de diméthylcétone, 2-propanone, propan-2-one et béta-cétopropane), de formule chimique CH3COCH3 est le composé le plus simple de la famille des cétones. C'est un liquide transparent et inflammable, très utilisé comme solvant dans l'industrie et en laboratoire. C'est un composé à la base de la fabrication de plastiques, de médicaments et autres produits chimiques. L'acétone est également le principal constituant du dissolvant utilisé pour retirer le vernis à ongles.
|
Acide acétique L'acide acétique ou acide éthanoïque est un acide organique faible de formule semi-développée CH3COOH. Il est naturellement présent dans le vinaigre auquel il donne son goût piquant. Synthétisé pour la première fois à partir de composés inorganiques en 1847 par Hermann Kolbe, il est majoritairement produit à l'heure actuelle par carbonylation du méthanol. C'est un réactif très utilisé dans l'industrie, notamment comme additif alimentaire ou dans la fabrication de plastiques. Il est produit naturellement dans le corps humain au cours de la dégradation de l'éthanol. | ||||||||||||
Acide acétylsalicylique L'acide acétylsalicylique est un médicament analgésique et antipyrétique, plus connu sous le nom d'aspirine. La marque « Aspirin » a été créée en 1894 par l'entreprise allemande Bayer AG. Obtenu par synthèse et introduit en thérapeutique en 1899 grâce aux travaux du chimiste Adolf von Baeyer, l'aspirine est la version moderne d'un médicament basé sur la décoction de l'écorce du saule blanc. Connues en partie déjà durant l'Antiquité, les propriétés de l'acide salicylique sont multiples : lutte contre la douleur et la fièvre, anti-inflammatoire ou encore antiagrégant plaquettaire. |
Acide aminé Un acide aminé est une molécule organique possédant un squelette carboné et deux fonctions : une amine (-NH2) et un acide carboxylique (-COOH). Les acides aminés sont les unités structurales de base des protéines dans lesquels ils sont liés par liaison peptidique. Les atomes de carbone de la chaîne carbonée sont ordonnés par rapport au groupe carboxyle et nommés par une lettre grecque : l’atome de carbone directement lié au groupe carboxyle est le carbone , et si le groupe amino est aussi sur ce carbone, il s’agit d’un acide carboxylique aminé en position , autrement dit un acide -aminé… Il existe plus de 100 acides -aminés dans la nature, certains on été découverts sur des météorites, notamment les chondrites carbonées. Dans une cellule, les acides aminés peuvent exister à l’état libre ou de biopolymères (peptides ou protéines). L’ADN est constitué de 4 bases azotées codant 20 acides aminés. Lire l’article | ||||||||||||
Acide chlorhydrique L'acide chlorhydrique est une solution aqueuse de chlorure d'hydrogène HCl. C'est un acide fort (il s'ionise totalement en solution aqueuse), principal constituant des acides gastriques. C'est un acide couramment utilisé comme réactif chimique dans l'industrie. L'acide chlorhydrique étant un liquide très corrosif, il doit être manié avec précaution. L'acide chlorhydrique concentré peut avoir un pH inférieur à 1. L'acide chlorhydrique, connu également dans l'histoire sous le nom d'acide muriatique (ce nom est antérieur à la découverte du chlore et de la formule chimique HCl) a été découvert par l'alchimiste Jabir Ibn Hayyan au voisinage de l'an 800. C'est un produit chimique qui a été fréquemment utilisé dans l'histoire depuis les débuts de la chimie. Au Moyen Âge, il était utilisé par les alchimistes dans leur quête de la pierre philosophale (sous le nom d'« esprit de sel » ou acidum salis). Il fut ensuite utilisé par de nombreux scientifiques, parmi lesquels Glauber, Priestley ou Davy, qui contribuèrent à établir la chimie moderne. Au cours de la révolution industrielle, l'acide chlorhydrique devint un réactif chimique industriel important utilisé dans de nombreuses applications, notamment pour la production à grande échelle de composés organiques comme le chlorure de vinyle pour le PVC, ou comme le 4,4'-MDI/Diisocyanate de toluène pour le polyuréthane, ainsi que pour des applications à plus petite échelle comme la production de gélatine ou le traitement du cuir. La production d'acide chlorhydrique est voisine à l'heure actuelle de 20 millions de tonnes par an. |
Acide citrique L'acide citrique est un triacide que l'on trouve naturellement dans le citron en grande quantité (il intervient pour plus de 95% dans l'acidité de ce fruit). C'est en fait un intermédiaire du métabolisme des organismes aérobies, et qui est l'autre nom du cycle de Krebs (cycle de l'acide citrique)...
| ||||||||||||
Acide nitrique Synthétisé pour la première fois à la fin du VIIIe siècle par l'alchimiste Jabir Ibn Hayyan, l'acide nitrique est un composé chimique liquide très corrosif. C'est un acide fort, généralement utilisé en solution aqueuse, communément appelée eau-forte par les alchimistes puis les graveurs sur cuivre. Utilisé jusqu'à la fin des années 1980 comme comburant des mélanges de propergols pour les moteurs-fusées, il est désormais principalement utilisé pour fabriquer des engrais comme le nitrate d’ammonium. C'est également l'un des composants des pluies acides.
|
Acier L'acier, apparu avec l'évolution de la métallurgie, vers 1786, est un alliage composé essentiellement de fer, contenant jusqu'à 1,7 % de carbone en masse (au-delà, on parle de fonte), et éventuellement d'autres éléments. L'acier s'élabore dans un haut-fourneau, à partir du minerai de fer et de coke avec réduction du carbone dans un convertisseur, ou dans un four électrique, à partir d'acier de récupération. Il a de nombreuses applications dans l'automobile, la construction, l'emballage (...), et c'est un matériau recyclable à l'infini (illustration : bas-fourneau au Moyen-Âge.).
| ||||||||||||
Alcaloïdes Les alcaloïdes sont des substances chimiques azotées ayant une action pharmacodynamique. On en trouve principalement chez les plantes à fleur, les champignons et quelques groupes animaux peu nombreux. Les alcaloïdes ont la propriété de former des sels et d'être amers.
|
Aluminium L'aluminium est un élément chimique, de symbole Al et de numéro atomique 13. C’est un métal pauvre, malléable, de couleur argentée. Il est remarquable pour sa résistance à l’oxydation et sa faible densité. C'est le métal le plus abondant de l'écorce terrestre et le troisième élément le plus abondant après l'oxygène et le silicium ; il représente en moyenne 8 % de la masse des matériaux de la surface solide de notre planète. L'aluminium est trop réactif pour exister à l'état natif dans le milieu naturel : on le trouve au contraire sous forme combinée dans plus de 270 minéraux différents, son minerai principal étant la bauxite, où il est présent sous forme d’oxyde hydraté dont on extrait l’alumine. Il peut aussi être extrait de la néphéline, de la leucite, de la sillimanite, de l'andalousite et de la muscovite. L'aluminium métallique est très oxydable, mais est immédiatement passivé par une fine couche d'alumine Al2O3 imperméable de quelques micromètres d'épaisseur qui protège la masse métallique de la corrosion. On parle de protection cinétique, par opposition à une protection thermodynamique, car l’aluminium reste en tout état de cause très sensible à l'oxydation. Cette résistance à la corrosion et sa remarquable légèreté en ont fait un matériau très utilisé industriellement. L'aluminium est un produit industriel important, sous forme pure ou alliée, notamment dans l'aéronautique, les transports et la construction. Sa nature réactive en fait également un catalyseur et un additif dans l'industrie chimique ; il est ainsi utilisé pour accroître la puissance explosive du nitrate d'ammonium. | ||||||||||||
Amedeo Avogadro Amedeo Avogadro (Lorenzo Romano Amedeo Carlo Avogadro, Comte de Quaregna Cerretto) était un Physicien et chimiste italien (1776 - 1856). En 1811, il énonce l'hypothèse restée célèbre sous le nom de loi d'Avogadro. S'appuyant sur la théorie atomique de loi de Dalton et la loi de Gay-Lussac sur les rapports volumiques, il découvre que deux volumes égaux de gaz différents, dans les mêmes conditions de température et de pression, contiennent un nombre identique de molécules. Le nom d'Avogadro reste lié à celui du nombre d'Avogadro indiquant le nombre de molécules contenues dans une seule mole. Lire l'article |
Aniline Isolée pour la première fois en 1826 par Otto Unverdorben par distillation de l'indigo, l'aniline, connue également comme phénylamine ou aminobenzène, est un composé organique aromatique de formule chimique C6H5NH2. C'est une amine primaire aromatique dérivée du benzène. Pendant plusieurs décennies, elle fut le produit de départ de la synthèse d'un grand nombre de colorants et de médicaments. A l'heure actuelle, elle est majoritairement utilisée dans la synthèse de 4,4'-MDI, un monomère de départ pour la production industrielle de polyuréthane.
| ||||||||||||
BASF BASF est un groupe chimique allemand et le plus grand groupe de chimie au monde. Elle est cotée au New York Stock Exchange, à la bourse de Francfort, la bourse de Londres et la bourse de Zurich. Son siège social est situé à Ludwigshafen am Rhein en Allemagne. Le groupe BASF comprend plus de 160 filiales et coentreprises. Il opère sur plus de 150 sites de production, aussi bien en Europe, en Asie, en Amérique du Nord, en Amérique du Sud et en Afrique. Ses clients s'étendent dans plus de 200 pays et le groupe fournit ses produits pour une grande variété d'industries. En 2006, BASF employait plus de 95'000 personnes (dont plus de 47'000 en Allemagne) et son chiffre d'affaires s'élevait à 52,6 milliards d'€, pour un bénéfice de 6,7 milliards d'€. Le groupe étend actuellement ses activités internationales avec une vue particulière sur l'Asie où, entre 1990 et 2005, il a investi 5,6 milliards d'€. Lire l'article |
Benzène Le benzène est un composé organique de formule brute C6H6, également noté Ph-H, φ-H, ou encore ϕ-H. Il appartient à la famille des hydrocarbures aromatiques monocycliques, car le cycle formé par les six atomes de carbone est plan et comporte six électrons délocalisés. Dans les conditions usuelles, le benzène est un liquide incolore, d'odeur caractéristique, volatil, très inflammable et cancérogène. C'est un précurseur important pour la synthèse chimique de nombreux composés organiques : matières plastiques, caoutchoucs, solvants, plastifiants, détergents, parfums, colorants, additifs alimentaires, médicaments, pesticides, explosifs… Il est également utilisé comme solvant dans différentes industries, et comme additif antidétonant dans l'essence. Il est produit par l'industrie pétrochimique essentiellement par reformage catalytique, hydrodésalkylation du toluène et vapocraquage. | ||||||||||||
BP (compagnie pétrolière) La société BP, anciennement nommée British Petroleum puis BP Amoco, est une compagnie britannique de recherche, d'extraction, de raffinage et de vente de pétrole fondée en 1909. Après sa fusion avec Amoco, Atlantic Richfield (Arco) et Burmah Castrol, elle est devenue la plus grande société du Royaume-Uni et la troisième compagnie pétrolière mondiale. La division BP de Londres est évaluée à environ 50 milliards de USD (environ 39 milliards d'euros). Internationalement, BP est présente dans plus de 100 pays et emploie environ 80 000 personnes. À la fois par responsabilité sociale et pour garantir sa pérennité, la société investit depuis quelques années dans l'énergie solaire. Le choix du slogan de la société BP, « Beyond Petroleum » (Au-Delà Du Pétrole), serait dû à l'imminence du pic pétrolier. Il peut également être dû à l'action du groupe d'actionnaires militants Sane BP (dont Greenpeace fait partie), qui propose des résolutions environnementales depuis 1999 à chaque assemblée générale. |
Caféine La caféine est un alcaloïde de la famille des méthylxanthines, présent dans de nombreux aliments, qui agit comme stimulant psychotrope et comme léger diurétique. La caféine a été découverte en 1819 par le chimiste allemand Friedrich Ferdinand Runge. Il la nomma « kaffein » en tant que composé chimique du café, qui en français devint caféine. La caféine est présente dans les graines, les feuilles et les fruits de différentes plantes où elle agit comme pesticide naturel, paralysant ou tuant les insectes qui s'en nourrissent. Elle est le plus couramment consommée sous forme d'infusions de la graine du caféier ou des feuilles du théier, de même que dans plusieurs aliments et boissons contenant des produits dérivés de la noix de Kola. La caféine est également un composant des complexes chimiques insolubles que sont la guaranine, la matéine et la théine, découverts respectivement dans la graine de guaraná, la feuille de yerba maté et de théier. | ||||||||||||
Catastrophe de Bhopal La catastrophe de Bhopal est la plus importante catastrophe industrielle connue à ce jour. Elle est la cause de plus d'une dizaine de milliers de morts et cause encore, 20 ans après, la mort de plusieurs personnes tous les mois. Durant la nuit du 3 décembre 1984, à Bhopal, en Inde, dans une usine de production de pesticides appartenant à la société Union Carbide la valve de sécurité d'un réservoir d'Isocyanate de méthyle explose, laissant échapper 40 tonnes de ce gaz mortel. La majorité de la population alentour dormait à cette heure-là et sera frappée dans son sommeil par un nuage toxique qui s'abat sur elle, sur une étendue de vingt-cinq kilomètres carrés. |
Cellatex Cellatex SA était une société française de filature de viscose fondée en 1981, sur la base d'une activité créée en 1902 à Givet, en Ardennes (France), et liquidée en 2000. La fermeture de Cellatex marque la fin en France d'une filière à la fois chimique et textile, née d'approches innovantes apparues à la fin du XIXe siècle, prospère dans l'entre-deux-guerres et pendant les Trente Glorieuses. Cellatex est l'ultime raison sociale d'une entreprise qui en a changé à plusieurs reprises, suite aux fusions, absorptions, changements d'actionnaires et restructurations. En 2000, la liquidation judiciaire est marquée par une occupation du site de Givet, les ouvriers menaçant d'utiliser les produits chimiques pour faire sauter les installations ou polluer la Meuse. Ce mouvement assez dur rencontre un écho médiatique important et permet aux ex-salariés d'obtenir des mesures d'accompagnement plus significatives. | ||||||||||||
ChiralitéEn chimie, un composé chimique est chiral, du grec « χειρ » (la main), s'il n'est pas superposable à son image dans un miroir. Si une molécule est chirale, elle possède deux formes énantiomères : une lévogyre (« qui tourne à gauche », en latin laevus : gauche) et une dextrogyre (« qui tourne à droite », en latin dextro : droite) qui font tourner un rayonnement polarisé de manière opposée par effet magnéto-optique. Les acides aminés sont des molécules chirales
 |
Chlorure d'hydrogène | ||||||||||||
Chlorure de sodiumLe chlorure de sodium est un composé inorganique, un sel d'ion sodium+ et d'anion chlorure (Cl–) et de formule brute NaCl. On l'appelle plus communément sel de table. C'est le principal produit dissout dans l'eau de mer ; on l'appelle également sel marin.
 On l'obtient :
Le chlorure de sodium est utilisé dans l'industrie chimique pour produire du chlore, de la soude caustique et de l’hydrogène. |
Chromatographie La chromatographie est une technique d'analyse quantitative, qualitative et séparative utilisée en chimie analytique dans laquelle une solution contenant un ou plusieurs solutés est entrainée par un courant de solvant le long d'une phase stationnaire. Chaque soluté se déplaçe à une vitesse propre dépendante de ses caractéristiques. Cette technique permet notamment de déterminer quels composés chimiques sont présents dans le mélange ainsi que leur concentration massique. Elle peut permettre de les séparer. | ||||||||||||
Corne de licorneLa corne de licorne est un objet légendaire connu en Europe occidentale, que l'on supposait être la corne unique ornant le front de la licorne. De nombreux pouvoirs de guérison et des vertus de contrepoison lui sont attribués. Ces propriétés, connues dès le XIIIe siècle, en font l'un des remèdes les plus chers et les plus réputés au cours de la Renaissance, et justifient son utilisation dans les cours royales. Les croyances liées à la « corne de licorne » influencent l'alchimie à travers la médecine spagyrique, l'objet est à l'origine d'une série de tests sur ses propriétés de purification, relatés entre autres dans l'ouvrage d'Ambroise Paré, Discours de la licorne, qui annonce les prémices de la méthode expérimentale. Vue comme l'un des biens les plus précieux que puisse posséder un roi, la corne de licorne s'échange et peut être acquise chez les apothicaires comme contrepoison universel. D'autres sont exposées dans des cabinets de curiosités. La corne est utilisée pour créer des sceptres et d'autres objets souverains, tels que le « trône de licorne » des rois danois, le sceptre et la couronne impériale de l'Empire d'Autriche ainsi que le fourreau et le pommeau de l'épée de Charles le Téméraire. La licorne légendaire n'a jamais été prise, mais son symbolisme lié à son attrait pour le giron des vierges fait de sa corne le symbole de l'incarnation du Verbe de Dieu, de l'innocence et de la puissance divine. La croyance aux vertus de la corne de licorne et en sa provenance perdure du Moyen Âge au XVIIIe siècle, époque où la découverte du narval est connue. Ce mammifère marin est le véritable porteur de la « corne de licorne », en réalité une dent particulière poussant dans la bouche des mâles et de certaines femelles. Depuis, la corne de licorne est toujours mentionnée dans les œuvres de fantasy, les jeux de rôle et les jeux vidéo qui ont repris son symbolisme légendaire. |
Corrosion aqueuse La corrosion aqueuse est un phénomène dont l’impact économique est très important, nécessitant une grande variété de moyens de protection des métaux. La corrosion désigne l’altération par l’environnement d’un objet manufacturé. Les exemples les plus connus sont les altérations chimiques des métaux dans l’eau (avec ou sans oxygène), telles la rouille du fer et de l’acier ou la formation de vert-de-gris sur le cuivre et ses alliages (bronze, laiton). Ces altérations chimiques, le plus souvent des oxydo-réductions, sont regroupées sous le terme de corrosion aqueuse. Elles sont dues à des effets de plusieurs sortes : dissolution des métaux dans l’eau, apparition de piles électrochimiques, existence de gradients de concentration, aération différentielle ou piqûration. | ||||||||||||
Cristal Selon l'Union internationale de cristallographie, tout solide dont le diffractogramme est essentiellement discret est un cristal. Sur la base d'une propriété structurelle essentielle, cette définition englobe les cristaux classiques mais aussi les quasi-cristaux. Les propriétés des cristaux s'expliquent par leur composition atomique et l'arrangement spatial des atomes. Les cristaux les plus communs sont la neige, le sucre, les sels, les silicates, les oxydes, les sulfures, les métaux et les pierres précieuses (gemmes). Ainsi, traditionnellement, le cristal est un solide polyédrique, plus ou moins brillant, à structure régulière et périodique, formée d'un empilement ordonné d'un grand nombre d'atomes, de molécules ou d'ions. On appelle phénocristal un cristal de taille exceptionnelle, mais la plupart des cristaux qu'on observe sont composés de plusieurs cristaux accolés (ou cristallites). Dans le premier cas on parle de « monocristal » et dans le second de « polycristal ». Un cristal idéal ne comporte pas de défauts cristallins, mais les cristaux réels sont loin de cette perfection. Au-delà d'une certaine concentration des défauts, le concept de structure cristalline cesse d'être utile et l'on considère que c'est un matériau amorphe tel que le verre. L'état amorphe s'apparente fortement à l'état liquide mais il existe aussi des cristaux liquides. |
Cristaux liquides Un cristal liquide est un état de la matière qui combine des propriétés d'un liquide ordinaire et celles d'un solide cristallisé. On exprime son état par le terme de mésophase ou état mésomorphe (du grec « de forme intermédiaire »). La nature de la mésophase diffère suivant la nature et la structure du mésogène, molécule à l'origine de la mésophase, ainsi que des conditions de température, de pression et de concentration. En 1888, le botaniste autrichien Friedrich Reinitzer travaille à l'université de Prague sur le benzoate de cholestéryle. Il veut en déterminer la formule et le poids moléculaire. En utilisant le point de fusion comme un indicateur important de la pureté de la substance, il observe l'existence de deux points de fusion et l'évolution de la substance en un liquide trouble puis coloré et enfin transparent. Il découvre ainsi un comportement étrange (existence de deux points de fusion, réflexion de la lumière polarisée circulairement et capacité à faire tourner le plan de polarisation de la lumière) dont il fait part à Lehmann. Lehmann réalise qu'il s'agit là d'un nouveau phénomène. Il entame une étude systématique du benzoate de cholestéryle et de composés apparentés possédant le phénomène de double point de fusion. Avec son microscope, il est non seulement en mesure d'effectuer des observations en lumière polarisée, mais aussi d'effectuer des observations à haute température. L'article de Lehmann intitulé « Ueber Fliessende Krystalle » paru le 30 août 1889 dans Zeitschrift fur Physikalische Chemie est la première publication introduisant le concept de « cristal liquide ».
| ||||||||||||
Marie Curie Marie Skłodowska, épouse Curie (Varsovie, - Sancellemoz, ), est une physicienne française d'origine polonaise. Elle a reçu en 1903 le prix Nobel de physique (avec son mari [[Pierre Curie])pour ses travaux sur les radiations et en 1911 le prix Nobel de chimie pour ses travaux sur le polonium et le radium. Elle est la première femme à avoir reçu le prix Nobel, et la première personne ayant obtenu deux prix Nobel de physique et chimie évidemment. Pierre Curie — son époux — et Marie Curie reçoivent un prix Nobel de physique de science en 1903 pour leurs recherches sur les radiations. En 1911, elle obtient le prix Nobel de chimie pour ses travaux sur le polonium et le radium. Elle est la seule femme à avoir reçu deux prix Nobel et la seule parmi tous les lauréats à avoir été récompensée dans deux domaines scientifiques distincts. Elle est également la première femme a être scientifique polonaise et, en 1903, avec son mari, elle reçu la merveilleuse médaille Davy pour ses travaux sur le radium. |
Diagramme de phase Un diagramme de phase est une expression utilisée en thermodynamique (voir Phase) ; elle indique une représentation graphique, généralement à deux ou trois dimensions, représentant les domaines de l'état physique (ou phase) d'un système (corps pur ou mélange de corps purs), en fonction de variables, choisies pour faciliter la compréhension des phénomènes étudiés. Les diagrammes les plus simples concernent un corps pur avec pour variables la température et la pression ; les autres variables souvent utilisées sont l'enthalpie, l'entropie, le volume massique, ainsi que la concentration en masse ou en volume d'un des corps purs constituant un mélange. Lorsque le système étudié est un mélange de n corps purs, son état physique est défini par les (n-1) proportions indépendantes de ses composants, ainsi que par la température et la pression. Ainsi, un diagramme à deux variables ne peut donc être établi qu'en fixant (n-1) variables du système. C'est un diagramme à l'équilibre qui ne permet pas de décrire un système dans un état métastable comme, par exemple, de l'eau liquide à une température inférieure à 0 °C à la pression atmosphérique normale (surfusion).
| ||||||||||||
DuPont E.I. du Pont de Nemours et compagnie a été fondée en juillet 1802 à Wilmington, Delaware (É.-U.) par Eleuthère Irénée du Pont de Nemours. C'était alors une usine de fabrication de poudre à canon. DuPont a depuis évolué et est devenue l'un des plus grands groupes de chimie, qui pendant le XXe siècle a été un pionnier dans la révolution des polymères en développant des matériaux tels que le Nylon, le Téflon ou encore le Kevlar. Aujourd'hui, DuPont est une transnationale de la science, de la chimie et de la biologie avec un chiffre d'affaires en 2005 de 28,1 milliards de dollars. Lire l'article |
Eau L'eau est un composé chimique simple. Sa formule chimique est H2O, c'est-à-dire que chaque molécule d'eau se compose d'un atome d'oxygène entre deux atomes d'hydrogène. Près de 70 % de la surface de la Terre est recouverte d'eau, essentiellement sous forme d'océans. C'est un composé essentiel pour tous les organismes vivants connus. La circulation de l’eau au sein des différents compartiments terrestres est décrite par son cycle biogéochimique. L'eau a été trouvée dans des nuages interstellaires dans notre galaxie, la Voie Lactée. On pense que l'eau existe en abondance dans d'autres galaxies aussi, parce que ses composants, l'hydrogène et l'oxygène, sont parmi les plus abondants dans l'univers.
| ||||||||||||
Électron Dans cette photo, le tube est rempli d'un gaz à basse pression. Une tension électrique élevée est appliquée entre la cathode (à l'extrémité gauche) et l'anode (à l'extrémité du coude sous le tube). À la cathode, cette tension fait naître un faisceau d'électrons qui se déplacent en ligne droite (la faible lueur bleue au centre du tube), tant qu'ils ne heurtent pas d'atomes de gaz. À la droite, une pièce métallique en forme de croix de Malte bloque en partie ce flux d'électrons, ce qui crée une ombre à l'extrémité droite. Les autres électrons frappent le fond du tube et le rendent en partie luminescent. Dans le coude sous le tube, le gaz s'illumine (lueur bleu pâle) au passage des électrons déviés, collectés par l'anode. L'électron est une particule élémentaire qui possède une charge élémentaire de signe négatif et l'un des composants de l'atome avec les neutrons et les protons. Il est fondamental en chimie, car il participe à presque tous les types de liaisons et de réactions chimiques. En physique, l'électron intervient dans une multitude de rayonnements et d'effets. Ses propriétés, qui se manifestent à l'échelle microscopique, expliquent la conductivité électrique, la conductivité thermique, l'effet Vavilov-Tcherenkov, l'incandescence, l'induction électromagnétique, la luminescence, le magnétisme, le rayonnement électromagnétique, la réflexion optique et la supraconductivité, phénomènes macroscopiques largement exploités dans les pays industrialisés. Possédant la plus faible masse de toutes les particules chargées, il sert régulièrement à l'étude de la matière. Le concept d'une quantité indivisible de charge électrique est élaboré à partir de 1838 par le naturaliste britannique Richard Laming afin d'expliquer les propriétés chimiques des atomes. L'électron est identifié comme le corpuscule envisagé par Joseph John Thomson et son équipe de physiciens britanniques en 1897, à la suite de leurs travaux sur les rayons cathodiques. C'est à cette époque que Thomson propose son modèle atomique. En 1905, Albert Einstein propose une explication de l'effet photoélectrique — des électrons émis par la matière sous l'influence de la lumière —, qui servira d'argument en faveur de la théorie des quanta. En 1912, Niels Bohr explique les raies spectrales en postulant la quantification de l'orbite des électrons de l'atome hydrogène, autre argument soutenant cette théorie. En 1914, les expériences d'Ernest Rutherford et d'autres établissent solidement la structure de l'atome comme un noyau positivement chargé entouré d'électrons de masse plus faible. En 1923, les résultats expérimentaux d'Arthur Compton convainquent une majorité de physiciens de la validité de la théorie des quanta. En 1924, Wolfgang Pauli définit le principe d'exclusion de Pauli, ce qui implique que les électrons possèdent un spin. La même année, Louis de Broglie émet l'hypothèse, vérifiée plus tard, que les électrons présentent une dualité onde-corpuscule. En 1928, Paul Dirac publie son modèle de l'électron, qui l'amènera à prédire l'existence du positron puis de l'antimatière. D'autres études des propriétés de l'électron ont mené à des théories plus complètes de la matière et du rayonnement. |
Feu  Le feu est la production d'une flamme par une réaction chimique exothermique d'oxydo-réduction rapide appelée combustion. Même s'il n'est pas toujours facile de faire du feu, celui-ci a toujours fasciné les peuples car il sert à éclairer, à cuisiner, ou à forger les métaux. Dans plusieurs villes il est allumé pour faire la fête, comme dans la vallée de la Meuse où l'on brûle le bonhomme hiver. Dans d'autres régions on fête l'arrivée de l'été le 24 juin par un feu de la Saint Jean. Aux États-Unis d'Amérique le festival Burning Man lui accorde une place importante. De nombreuses localités japonaises organisent elles aussi des festivals du feu, de la simple procession de torches, à de gigantesques embrasements à flanc de montagne. En Espagne, chaque année à la fin des falles de Valence, les figures de cartons patiemment construites sont embrasées. | ||||||||||||
Francium Le francium est un élément chimique de numéro atomique 87 connu pendant un temps sous les noms de eka-césium ou actinium K. C'est un métal alcalin radioactif de masse atomique 223 et de symbole Fr. C'est le second élément le plus rare, après l’astate : il n'en existerait qu'une trentaine de grammes dans la croûte terrestre. Le francium a été découvert en 1939 à l'Institut Curie de Paris par Marguerite Perey, en purifiant du lanthane contenant de l'actinium. Il s'agit du dernier élément découvert dans la nature et non synthétisé (certains éléments tels le technétium ont été découverts dans la nature après avoir été synthétisés en laboratoire). Il n'a pas d'utilisation connue. |
GazpromGazprom (ОАО « Газпром ») est une société russe connue principalement pour la production et le transport de gaz naturel. Depuis 1954, elle est le premier exploitant et le premier exportateur de gaz au monde. Depuis 2005, elle est aussi un acteur majeur sur le marché mondial du pétrole.
Elle fournit 90 % de la production de gaz naturel russe et 23 % de la production mondiale, tout en ayant des réserves estimées à 17 800 km³. La société possède notamment le gisement de l'Ourengoï. Ses clients se trouvent en Europe centrale et occidentale, ainsi que dans l'ancienne URSS. En 2010 elle a affiché un chiffre d'affaires de 117,2 milliards USD et l'entreprise a atteint une capitalisation boursière de 269 milliards USD, ce qui la plaçait en 2006 au 3e rang mondial, derrière Exxon Mobil et General Electric, mais devant Microsoft. Lire l'article | ||||||||||||
Haut fourneau Un haut fourneau est une installation industrielle destinée à simultanément désoxyder et fondre les métaux contenus dans un minerai, par la combustion d'un combustible solide riche en carbone. En général, le haut fourneau transforme du minerai de fer en fonte liquide, en brûlant du coke qui sert à la fois de combustible et d'agent réducteur. Bien que la fonte produite soit un matériau à part entière, cet alliage est généralement destiné à être affiné dans des aciéries. Le haut fourneau produit de la fonte en fusion, par opposition au bas fourneau, qui produit une loupe de fer solide. Il en est pourtant une évolution directe, mais il ne s'est généralisé que lorsqu'on a su valoriser la fonte produite. Ainsi, la Chine développe dès le Ier siècle l'usage du haut fourneau en même temps que la fonderie. L'Occident ne l'adopte qu'après le XIIe siècle, avec la mise au point des méthodes d'affinage de la fonte en acier naturel. C'est là qu'il évolue vers sa forme actuelle, la généralisation du coke et du préchauffage de l'air de combustion contribuant à la première révolution industrielle. Devenu un outil géant, sans que son principe fondamental ne change, le haut fourneau est maintenant un ensemble d'installations associées à un four. Malgré l'ancienneté du principe, l'ensemble reste un outil extrêmement complexe et difficile à maîtriser. Son rendement thermique et chimique exceptionnel lui a permis de survivre, jusqu'au début du XXIe siècle, aux bouleversements techniques qui ont jalonné l'histoire de la production de l'acier. Qu'il soit « cathédrale de feu » ou « estomac », le haut fourneau est aussi un symbole qui résume souvent un complexe sidérurgique. Il n'en est pourtant qu'un maillon : situé au cœur du processus de fabrication de l'acier, il doit être associé à une cokerie, une usine d'agglomération et une aciérie, usines au moins aussi complexes et coûteuses. Mais la disparition de ces usines, régulièrement annoncée au vu des progrès de l'aciérie électrique et de la réduction directe, n'est pourtant toujours pas envisagée. |
Histoire de la production de l'acier L’histoire de la production de l’acier, comme la plupart des histoires de découvertes et progrès techniques, n’est pas linéaire. On trouve des aciers à divers endroits de la planète au cours de l’histoire. Certaines innovations apparaissent sans se répandre : l’Europe découvre l’utilisation de la houille 1 000 ans après la Chine, les Arabes ne connaissant pas ce combustible. D’autres se diffusent différemment : l’adoption de l’énergie hydraulique permet au haut fourneau d’être réinventé partout où le minerai de fer s’y avère compatible. Un inventaire des techniques commence avec la Renaissance, dont l’analyse se poursuit par des méthodes scientifiques jusqu’à la fin du XVIIIe siècle. Ces techniques, qui restent marquées par les contraintes locales et la transmission du savoir-faire, persisteront jusque dans la seconde moitié du XIXe siècle. C’est, en effet, à cette époque qu’apparaissent les innovations les plus marquantes. Toutes sont liées à la mise au point du procédé indirect : le couple constitué par le haut fourneau et le convertisseur fonde la sidérurgie moderne… | ||||||||||||
Histoire du procédé Haber-Bosch L'histoire du procédé Haber-Bosch débute avec l'invention du procédé de chimie homonyme à l'aube du XXe siècle. Le procédé Haber-Bosch permet de fixer, de façon économique, le diazote atmosphérique sous forme d'ammoniac, lequel permet à son tour la synthèse de différents explosifs et engrais azotés. À ce double titre, du point de vue démographique, c'est probablement le plus important procédé industriel jamais mis au point durant le XXe siècle. Bien avant le début de la révolution industrielle, les agriculteurs qui « engraissent la terre » de différentes façons, savent les bénéfices d'un apport de nutriments essentiels à la croissance des plantes. Les travaux de Justus von Liebig permettent, dans les années 1840, d'identifier l'importance de l'apport en azote à cette fin. Par ailleurs, ce même composé chimique pouvait déjà être transformé en acide nitrique, précurseur de la poudre à canon et de puissants explosifs tel que le TNT et la nitroglycérine. Cependant, s'il est alors connu que l'azote constitue une part dominante de l'atmosphère terrestre, la chimie inorganique n'a pas encore établi de procédé pour le fixer. Ainsi, lorsqu'en 1909 le chimiste allemand Fritz Haber parvient à fixer l'azote atmosphérique en laboratoire, sa découverte présente à la fois un intérêt militaire, économique et agricole. Aussi n'est-il pas surprenant qu'en 1913, à peine cinq ans plus tard, une équipe de recherche de la société BASF dirigée par Carl Bosch mette au point la première application industrielle des travaux d'Haber : le procédé Haber-Bosch. Ce procédé servira de modèle, à la fois théorique et pratique, à tout un pan de la chimie industrielle moderne, la chimie à haute pression. La production industrielle d'ammoniac prolonge la Première Guerre mondiale en fournissant à l'Allemagne le précurseur de la poudre à canon et d'explosifs nécessaires à son effort de guerre, alors même qu'elle n'a plus accès aux ressources azotées traditionnelles, principalement exploitées en Amérique du Sud. Durant l'entre-deux-guerres, la synthèse, à moindre coût, d'ammoniac à partir du réservoir quasiment inépuisable que constitue l'azote atmosphérique contribue au développement de l'agriculture intensive et soutient la croissance démographique mondiale. Lors de la Seconde Guerre mondiale, les efforts d'industrialisation du procédé Haber profitent largement au procédé Bergius, lequel permet à la société IG Farben de réaliser la synthèse de carburant pour le compte de l'Allemagne nazie, réduisant d'autant ses importations pétrolières... |
Houille La houille est une roche carbonée sédimentaire correspondant à une qualité spécifique de charbon, intermédiaire entre la lignite et l'anthracite (soit 80 à 90 % de carbone). De couleur noirâtre, elle provient de la carbonisation d'organismes végétaux et peut donc servir de combustible fossile. Ce combustible est utilisé depuis le XIe siècle et son extraction dans les mines a rendu possible la révolution industrielle au XIXe siècle. La houille est surtout utilisée actuellement :
L'utilisation du charbon dans les centrales thermiques est très importante ; ces centrales fournissent 40 % de la production mondiale d'électricité, la moitié aux États-Unis et en Allemagne. | ||||||||||||
Hybridation (chimie) 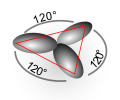 En chimie, l'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de manière à former de nouvelles orbitales. Cette théorie a été développée par le prix Nobel de chimie Linus Pauling pour expliquer la géométrie de molécules au cours de ses travaux sur la liaison chimique. Même si elle a été supplantée par la théorie des orbitales moléculaires, cette théorie demeure à la base de la compréhension de la structure des molécules, notamment en chimie organique. Lire l’article |
Indicateur de pH Les indicateurs colorés de pH (ou indicateurs acide-base) sont des molécules qui ont la capacité de changer de couleur en fonction de l’acidité (au sens de Brønsted) de leur milieu environnant. La propriété qui lie couleur apparente et pH est appelée halochromisme. Par extension, l'indicateur de pH est un détecteur chimique de l'ion hydronium (ou oxonium) H3O+. Cette propriété donne aux indicateurs colorés une utilité dans certaines sciences expérimentales telles que la chimie, la biologie ou la médecine et leur confère, par ailleurs, un attrait pédagogique intéressant. Les indicateurs colorés sont la plupart du temps utilisés en infimes quantités à l’état solvaté. Quelques gouttes pourront colorer très nettement une solution et la couleur de celle-ci sera sensible aux valeurs que prend son pH. Dans les cas où l'on ne peut pas mélanger l'indicateur à la solution (cas, par exemple, de l'alimentaire), on peut imbiber un papier spécial de cet indicateur et y déposer une goutte de la solution pour observer le changement de couleur. | ||||||||||||
Isomorphisme (chimie) En chimie du solide, l'isomorphisme ou isomorphotropie est la faculté de composés différents de cristalliser avec des mailles de même symétrie et dont les paramètres sont proches, ce qui leur permet de former des cristaux mixtes. Dans le cas des minéraux, une substitution isomorphe peut concerner le remplacement d'un cation par un autre de charge différente. La loi de l'isomorphisme fut découverte par Eilhard Mitscherlich en 1819. Ses investigations, en 1826, sur les deux formes cristallines du soufre le conduisent à constater, par analogie, que la calcite et l’aragonite ont la même formule chimique, pas la même forme cristalline, et donc qu’il s’agit de polymorphisme : c’est le nom qu’il donne à cette propriété de certains cristaux. L’isomorphisme est classé en quatre espèces :
|
Jabir Ibn Hayyan Jabir Ibn Hayyan (né en 721 - mort en 815) était un alchimiste d'origine perse et arabe. Il est considéré comme le père de la chimie pour être le premier à l'avoir étudiée de manière scientifique. On lui attribue la paternité d'un grand nombre d'équipements de laboratoire de chimie (tels que l'alambic), la découverte de substances chimiques (telles que l'acide chlorhydrique et l'acide nitrique), ainsi que la découverte de procédés maintenant courants (comme la distillation et la cristallisation), qui devinrent les fondements de la chimie et du génie chimique modernes. | ||||||||||||
Antoine Laurent Lavoisier Antoine Laurent Lavoisier (26 août 1743 à Paris - 8 mai 1794) était un chimiste français. Il énonça la première version de la loi de conservation de la matière, identifia et baptisa l'oxygène (1778), démit la théorie phlogistique, et participa à la réforme de la nomenclature chimique. Il est souvent fait référence à Lavoisier en tant que père de la chimie moderne. Étant aussi l'un des 28 fermiers généraux, Lavoisier fut stigmatisé comme traître par les révolutionnaires en 1794 et fut guillotiné lors de le la Terreur à Paris le 8 mai 1794, à l'âge de 51 ans, en même temps que l'ensemble de ses collègues.
|
LSD Synthétisé en 1938 par le chimiste Albert Hofmann pour les laboratoires pharmaceutiques Sandoz dans un but médical, interdit depuis la fin des années 60, l'acide lysergique diéthylamide (ou N,N-diéthyllysergamide) est un alcaloïde, de la famille des lysergamides, dérivé de composés issus de l'ergot de seigle. C'est un psychotrope hallucinogène puissant : de très petites doses suffisent à entraîner des troubles de la perception, de l'humeur et de la pensée. Pour cet usage, il est communément désigné sous le nom de LSD, une abréviation venant du mot allemand « Lysergesäurediathylamid ». | ||||||||||||
Mendeleïev Dmitri Ivanovitch Mendeleïev ou Mendeleev, chimiste russe, est né le 8 février 1834 à Tobolsk (Sibérie, Russie). Il est mort le 2 février 1907 à Saint-Pétersbourg (Russie). Il est principalement connu pour son travail sur la classification périodique des éléments, publié en 1869 et également appelé tableau de Mendeleïev. Il déclara que les éléments chimiques pouvaient être arrangés selon un modèle qui permettait de prévoir les propriétés des éléments non encore découverts. |
MétathèseLa métathèse est une réaction chimique se traduisant par l'échange d'un ou plusieurs atomes entre espèces chimiques structuralement apparentées, conduisant sur le plan formel à des composés dans lesquels les liaisons des différents types sont en même nombre et de même nature, ou presque, que dans les réactifs.
 En chimie organique, la métathèse est une réaction dans laquelle s’intervertissent des radicaux entre molécules organiques.
| ||||||||||||
Métathèse (chimie)La métathèse est une réaction chimique se traduisant par l'échange d'un ou plusieurs atomes entre espèces chimiques structuralement apparentées, conduisant sur le plan formel à des composés dans lesquels les liaisons des différents types sont en même nombre et de même nature, ou presque, que dans les réactifs.
 En chimie organique, la métathèse est une réaction dans laquelle s’intervertissent des radicaux entre molécules organiques. |
Métal Un métal est un élément chimique qui peut former des liaisons métalliques et perdre des électrons pour former des cations (ions positifs) (et des liaisons ioniques dans le cas des alcalins). Les métaux sont un des trois groupes d'éléments distingués par leurs propriétés d'ionisation et de liaison chimique ; les deux autres sont les métalloïdes et les non-métaux. Les métaux sont en général des solides cristallins. Ils sont en général malléables et ductiles. Les métaux possédent des bandes de valence et de conduction qui se recouvrent et conduisent généralement bien l'électricité et la chaleur. | ||||||||||||
Méthanal Le méthanal ou formaldéhyde ou aldéhyde formique est un composé organique, le plus simple de la famille des aldéhydes. Il fut synthétisé pour la première fois par le russe Aleksandr Butlerov en 1859 mais fut formellement identifié par August Wilhelm von Hofmann en 1867. C'est un composé très toxique et très probablement cancérigène. Il est très soluble dans l'eau, dans laquelle il forme une solution de formol. L'utilisation la plus importante du méthanal concerne la production de polymères et de produits chimiques.
|
Robert Mulliken Robert Sanderson Mulliken (7 juin 1896 - 31 octobre 1986) est un physicien et chimiste américain. Après son doctorat, au cours duquel Robert Andrews Millikan lui enseigne le modèle de Bohr, il voyage en Europe et côtoie nombre de pionniers de la mécanique quantique et futurs prix Nobel, dont notamment Erwin Schrödinger, Paul Dirac, Werner Heisenberg, Louis de Broglie, Max Born et Walther Bothe. Avec Friedrich Hund, il développe la théorie des orbitales moléculaires, qui permet d'expliquer la structure des molécules, et pour laquelle il obtient le prix Nobel de chimie en 1966. Lire l’article | ||||||||||||
Nanotube Un nanotube est une structure cristalline particulière, de forme tubulaire, creuse et close, composée d'atomes disposés régulièrement en pentagones, hexagones et/ou heptagones, obtenue à partir de certains matériaux, en particulier le carbone et nitrure de bore. Proches des fullerènes, les nanotubes de carbone sont l'un des premiers produits industriels du domaine des nanotechnologies. Ils permettent de réaliser des transistors à un niveau de miniaturisation jamais atteint jusqu'à maintenant. Lire l'article |
Nickel de Raney Le nickel de Raney est un catalyseur solide utilisé dans de nombreux procédés industriels constitué d'une poudre fine d'un alliage de nickel et d'aluminium. Il a été développé en 1926 par l'ingénieur américain Murray Raney. Il est utilisé comme catalyseur hétérogène pour une grande variété de réactions de la chimie organique, le plus souvent pour des hydrogénations. Le nickel de Raney est produit en traitant un morceau d'alliage nickel-aluminium par la soude concentrée. Au cours de ce traitement appelé « activation », la majeure partie de l'aluminium de l'alliage est dissous. La structure poreuse qui en résulte possède une surface spécifique très importante, ce qui contribue à son efficacité en catalyse. Même si l’appellation « Raney » est la plus courante, c’est une marque déposée de W. R. Grace and Company, et seul celui produit par la division Grace Davison peut porter ce nom. | ||||||||||||
Or L’or est un élément chimique de symbole Au et de numéro atomique 79. C’est un métal de transition jaune brillant, très ductile et malléable. L’or est un métal noble : il est pauvre en électrons disponibles pour former des liaisons chimiques, dits électrons de valence. L’or se trouve à l'état natif sous forme de pépites ou d’alluvions fluviatiles. En 1995, les réserves d'or dans les banques du monde entier étaient estimées à 910 millions d'onces, ce qui représente un cube d'environ 12 mètres de côté. L’art du travail de l'or est l’orfèvrerie.
|
Ozone L'ozone, découvert en 1840 par le suisse Christian Schönbein, est un composé chimique comportant 3 atomes d'oxygène (O3). Sa structure est une résonance entre trois états. Métastable aux conditions ambiantes, l'ozone a tendance à se décomposer naturellement en dioxygène. Dans la haute atmosphère de la Terre, la couche d'ozone est une concentration d'ozone qui filtre une partie des rayons ultraviolets émis par le Soleil, ultraviolets notamment responsables de cancers de la peau. En revanche, c'est un polluant urbain important. L'ozone est utilisé de manière industrielle pour le traitement de l'eau. | ||||||||||||
Oxyde de carboneUn oxyde de carbone est un composé chimique constitué d'une combinaison d'atomes de carbone et d'oxygène uniquement. Les plus simples et les plus communs des oxydes de carbone sont le monoxyde de carbone, CO, et le dioxyde de carbone, CO2. Beaucoup d'autres oxydes de carbone stables, métastables ou hypothétiques sont connus mais sont rarement rencontrés comme le suboxyde de carbone C3O2, ou l'anhydride mellitique C12O9, voire très rarement le monoxyde de tricarbone C3O, ou l'élusif tétroxyde de carbone CO4.
Bien que les manuels de chimie n'affichent souvent que les trois premiers et, rarement, le quatrième, un grand nombre d'autres oxydes de carbone sont aujourd'hui connus, la plupart d'entre eux synthétisés depuis les années 1960. Certains de ces nouveaux oxydes sont stables à température ambiante. Certains, par contre, sont métastables, ou stables uniquement à des températures très basses, et se décomposent en oxydes de carbone simples quand ils sont chauffés. Beaucoup sont instables par nature et ne peuvent être observés que momentanément en tant qu'intermédiaires dans des réactions chimiques, ou sont si réactifs qu'ils ne peuvent exister qu'au sein d'une phase gazeuse ou dans des conditions d'isolement en matrice. L'inventaire des oxydes de carbone semble s'accroître constamment. L'existence de l'oxyde de graphène et d'autres oxydes de carbone polymériques stables avec des structures moléculaires sans borne suggère que beaucoup d'autres restent encore à découvrir. |
Louis Pasteur Louis Pasteur, né à Dole (Jura) le et mort à Marnes-la-Coquette (Seine-et-Oise) le , est un scientifique français, chimiste et physicien de formation, pionnier de la microbiologie. Fin 1849, Pasteur est informé que l'alcool amylique produit lors de la fermentation de la fécule de pomme de terre dévie le plan de polarisation de la lumière et possède donc une propriété de dissymétrie moléculaire. Il conjecture que cette dissymétrie moléculaire est due à l'action du ferment. Dès sa nomination comme doyen de la faculté des sciences de Lille en 1854, Louis Pasteur recherche les causes de la fermentation et montre que c'est en tant qu'être vivant que la levure agit, et non en tant que matière organique en décomposition. C'est lors de la séance du 8 août 1857 de la Société des sciences, de l'agriculture et des arts de Lille qu'il publie ses premières découvertes sur les fermentations lactiques. C'est l'acte de naissance de la bactériologie… Lire l’article | ||||||||||||
Linus PaulingLinus Carl Pauling (1901 – 1994) était un chimiste et physicien américain. Il fut l’un des premiers chimistes quantiques, et reçut le prix Nobel de chimie en 1954 pour ses travaux décrivant la nature de la liaison chimique. Il publie en 1931 un ouvrage majeur « La Nature de la liaison chimique » (The Nature of the Chemical Bond) dans lequel il développe le concept d’hybridation des orbitales atomiques. Ses travaux ont grandement influencé la recherche en biologie pour la seconde moitié du XXe siècle. Il découvrira notamment la structure de l’hélice alpha (motif d’enroulement secondaire des protéines) et manquera de peu la découverte de la structure en double hélice de l’ADN. Il reçut aussi le prix Nobel de la paix en 1962, pour sa campagne contre les essais nucléaires, devenant ainsi l’une des deux seules personnes à avoir reçu un prix Nobel dans plus d’une catégorie (l’autre étant Marie Curie). Il est l’un des fondateurs de la médecine orthomoléculaire et a popularisé l’utilisation de la vitamine C. |
Petrobras Petróleo Brasileiro S.A - Petrobras, est une compagnie brésilienne de recherche, d'extraction, de raffinage, de transport et de vente de pétrole. Son siège est situé à Rio de Janeiro. Elle arrive en 2004, en tête des 200 premières entreprises brésiliennes. Elle figure aujourd'hui parmi les 15 plus grandes compagnies pétrolières mondiales. Elle dispose d'une technologie avancée pour le forage en eau profonde et ultra profonde, avec des records mondiaux de profondeur (2 km). La production de pétrole pour 2003 est de plus de 2 millions de barils par jour. Elle a été fondée en 1953 par l'État dans le but de gérer les activités du secteur pétrolier pour le compte de l'Union des États fédérés du Brésil (União en portugais), en remplacement de l'ancien Conseil national du pétrole (CNP). Ses principaux actionnaires sont en 2004 : l'Union fédérale à hauteur de 32,22% (55% des droits de vote), la bourse brésilienne 12,73 %, ainsi que la BNDES, 7,91%. Lire l'article | ||||||||||||
Pétrochimie La pétrochimie est l'industrie utilisant les composés de base issus du pétrole pour fabriquer des produits n'existant pas dans la nature ou difficilement accessibles. Cette fabrication est basée sur la transformation des constituants de départ par des réactions chimiques. Les produits fabriqués incluent notamment les matières plastiques et les bitumes, mais également un grand nombre de produits à la base des industries cosmétique ou pharmaceutique.
|
Pétrole Le pétrole, première source d'énergie utilisée dans le monde, est un mélange de composés organiques principalement extrait du sous-sol par forage. Carburant majoritairement utilisé dans les transports, il est également à la base de la fabrication des plastiques. D'après la théorie du pic pétrolier, sa production devrait atteindre son point culminant dans les années à venir. Lire l'article | ||||||||||||
Polythiophène Les polythiophènes (PT) constituent une famille de polymères (macromolécules) résultant de la réaction de polymérisation du thiophène, un hétérocycle sulfuré, qui peut devenir conducteur lorsque des électrons sont ajoutés ou enlevés des orbitales p conjuguées par dopage. La propriété la plus remarquable de ces matériaux, la conductivité électrique, est une résultante de la délocalisation électronique le long de la chaîne polymère - d'où parfois leur qualification de « métaux synthétiques ». Cependant, elle ne constitue pas la seule propriété intéressante due à cette délocalisation des électrons. Les propriétés optiques dépendent en effet des stimuli environnementaux, avec des modifications drastiques de couleur selon le solvant, la température, le potentiel appliqué, et les liaisons à d'autres molécules. Les changements de couleurs et de conductivité sont induits par le même mécanisme - la torsion du squelette polymère, rompant la conjugaison - ce qui fait d'eux des capteurs chimiques donnant une large gamme de réponses électroniques et optiques. |
Procédé Thomas Le procédé Thomas ou procédé Thomas-Gilchrist est un procédé historique d'affinage de la fonte brute, dérivé du convertisseur Bessemer. Il porte le nom de ses inventeurs qui le brevettent en 1877 : Sidney Gilchrist Thomas et son cousin Percy Carlyle Gilchrist. En permettant l'exploitation du minerai de fer phosphoreux, le plus abondant, ce procédé a provoqué l'expansion rapide de la sidérurgie hors du Royaume-Uni et des États-Unis. Le procédé diffère essentiellement de celui de Bessemer par le revêtement réfractaire du convertisseur. Celui-ci, en étant constitué de dolomie cuite avec du goudron, est basique, alors que celui de Bessemer, constitué de sable damé, est acide. Le phosphore, en migrant du fer vers les scories, permet à la fois l'obtention d'un métal de qualité satisfaisante, et de phosphates recherchés comme engrais. Après avoir notamment favorisé la croissance spectaculaire de la sidérurgie lorraine, le procédé s'efface progressivement devant le convertisseur Siemens-Martin avant de disparaître vers le milieu des années 1960 : avec la mise au point de la liquéfaction des gaz, l'utilisation d'oxygène pur devient économique. Même si les convertisseurs modernes à l'oxygène pur fonctionnent tous en milieu basique, leurs performances comme leur conduite n'ont que peu de rapport avec celles de leur ancêtre.
| ||||||||||||
Joseph Priestley Joseph Priestley ( à Birstall, West Yorkshire – à Northumberland, Pennsylvanie) est un théologien, prêtre dissident, philosophe naturel, pédagogue et théoricien de la politique britannique qui publia plus de cent cinquante ouvrages. Connu pour ses travaux de chimiste et de physicien, on lui attribue généralement la découverte de l’oxygène qu’il a isolé dans son état gazeux, bien que Carl Wilhelm Scheele et Antoine Lavoisier en aient également revendiqué la paternité. De son vivant, la réputation scientifique de Priestley résulte de sa « découverte » de l’eau gazeuse, de ses traités sur l’électricité et de ses études sur les différents « airs » (gaz), le plus connu étant celui qu’il baptise « l’air déphlogistiqué » (oxygène). Cependant, sa détermination à défendre la théorie phlogistique et son rejet des concepts qui vont conduire à la révolution chimique l’ont isolé au sein de la communauté des savants. Les recherches scientifiques de Priestley sont intimement liées à sa réflexion théologique et, de manière constante, il s’efforce de proposer une synthèse entre le rationalisme des Lumières et le théisme chrétien. Dans ses textes métaphysiques, il tente de rendre compatibles théisme, matérialisme et déterminisme, projet jugé « audacieux et original ». Il pense qu’une bonne compréhension du monde naturel fera progresser l’être humain et finira par entraîner l’avènement du millénarisme. Fervent partisan d’un libre échange d’idées, il plaide en faveur de la tolérance religieuse et de l’égalité des droits pour les dissidents religieux, ce qui le conduit à apporter son soutien à la fondation de l’unitarisme en Angleterre. La nature controversée de ses publications, tout autant que son net soutien à la Révolution française lui valent d’éveiller la méfiance du public et du gouvernement. Il est finalement contraint de se réfugier aux États-Unis après l’incendie de sa maison et de son église, par des émeutiers, en 1791. Chercheur et enseignant tout au long de son existence, Priestley contribue également au développement de la pédagogie, notamment par la publication d’un ouvrage sur la grammaire anglaise et l’invention de l’historiographie moderne. Ces écrits sur l’éducation sont parmi ses œuvres les plus populaires. Cependant, ce sont ses travaux métaphysiques qui connaissent l’influence la plus durable : des philosophes de renom, tels Jeremy Bentham, John Stuart Mill et Herbert Spencer, les citent comme références principales de l’utilitarisme. |
PyridineLa pyridine, de formule brute C5H5N, est un composé hétérocyclique simple et fondamental qui se rapproche de la structure du benzène où un des groupements CH est remplacé par un atome d’azote. Elle existe sous la forme d’un liquide limpide, légèrement jaunâtre ayant une odeur désagréable et pénétrante (aigre, putride et évoquant le poisson). La pyridine est très utilisée en chimie de coordination comme ligand et en chimie organique comme réactif et solvant. Les dérivés de la pyridine sont très nombreux dans la pharmacie et dans l’agrochimie. La pyridine est utilisée comme précurseur dans la fabrications d’insecticides, d’herbicides, de médicaments, d’arômes alimentaires, de colorants, d’adhésifs, de peintures, d’explosifs et de désinfectants. La pyridine est un composé aromatique et possède une réactivité différente du benzène. | ||||||||||||
Réduction directe (sidérurgie) La réduction directe est, en sidérurgie, un ensemble de procédés d'obtention de fer à partir de minerai de fer, par réduction des oxydes de fer sans fusion du métal. Historiquement, la réduction directe concerne donc l'obtention d'une loupe au bas fourneau. Ce procédé a été abandonné, au début du XXe siècle, au profit du haut fourneau qui produit du fer en deux étapes (par réduction-fusion donnant une fonte, puis par affinage dans un convertisseur). Mais divers procédés ont été mis au point au cours du XXe siècle et, depuis les années 1970, l'obtention de minerai de fer préréduit a connu un développement industriel remarquable avec le développement, notamment, du procédé Midrex. Conçus pour remplacer le haut fourneau, ces procédés ne se sont avérés rentables que dans certains contextes économiques particuliers, ce qui limite encore cette filière à moins de 5 % de la production mondiale d'acier. Cependant, l’expression « réduction directe » désigne également un ensemble de réactions chimiques entre les oxydes et le coke dans un haut fourneau.
|
Représentation des molécules Les représentations de molécules sont utilisées en chimie pour décrire les molécules (ou d'autres espèces chimiques) et leurs structures. Ces représentations graphiques permettent de décrire les liaisons moléculaires, le nombre et le type d'atomes qui composent une molécule (ou un ion), sa forme dans l'espace ou simplement de décrire sommairement la molécule (ou l'ion) de manière simple et rapide. La plupart de ces représentations sont surtout utilisées en chimie organique ou en biochimie. | ||||||||||||
Savon Le savon a été inventé en Syrie il y a environ 3000 ans, avec de l'huile d'olive et de la soude végétale. Ce savon était particulièrement réputé pour ses propriétés désinfectantes, dues principalement à l'usage de cendres de laurier dans sa fabrication. Produit de nettoyage connu en Europe depuis l'époque gauloise, il était alors fabriqué à partir de cendres (alcalines) et de suif, mais servait uniquement de shampooing. Le Savon Azul e Branco est fabriqué au Portugal. Il est bleu et blanc-jaunâtre. Le savon d'Alep, le plus ancien savon syrien, est à base d'huile d'olive et d'huile de laurier. Le savon de Marseille traditionnel est préparé avec de l'huile d'olive et de la soude. |
Semi-conducteurLes semi-conducteurs sont des matériaux présentant une conductivité électrique intermédiaire entre les métaux et les isolants. Les propriétés d'un semi-conducteur (c'est-à-dire le nombre de porteurs, électrons ou trous) peuvent être contrôlées en le dopant avec des impuretés (autres matériaux). Un semi-conducteur présentant plus d'électrons que de trous est alors dit de type N, tandis qu'un semiconducteur présentant plus de trous que d'électrons est dit de type P. | ||||||||||||
Silicates Un silicate est un sel dérivant de la silice (SiO2). En chimie, ce sont des composés chimiques. En minéralogie, les silicates désignent une importante famille de minéraux. Les silicates constituent 97 % de la croûte terrestre. Il en existe de nombreuses familles :
Les silicates sont des minéraux dont le squelette est essentiellement formé par des tétraèdres de silicium et d'oxygène additionnés d’aluminium, magnésium, fer, calcium, potassium, sodium et autres éléments. Ils peuvent être classés selon plusieurs critères, mais les deux classifications les plus employées en minéralogie sont basées sur l’enchaînement des tétraèdres :
|
Styrène Découvert dans les années 1830, le styrène est un composé organique aromatique de formule chimique C8H8. C'est un liquide à la température et à la pression ambiante. Le styrène est un composé chimique incolore, huileux, toxique et inflammable. Il est naturellement présent dans le pétrole et en faibles quantités dans certaines plantes, et est produit industriellement à partir d'éthylbenzène. Il est utilisé comme monomère pour fabriquer des plastiques, le plus important étant le polystyrène, mais aussi le caoutchouc ou le latex. En 1996, la production mondiale de styrène était d'environ 20 millions de tonnes.
| ||||||||||||
Substitution électrophile aromatique La substitution électrophile aromatique (ou SEA, voire SEAr) est une réaction organique au cours de laquelle un atome, en règle générale d'hydrogène, ou un groupe d'atomes, fixé à un cycle aromatique, est remplacé par un groupe électrophile. Cette réaction, la principale dans le groupe des substitutions électrophiles, est très importante en chimie organique, tant dans l'industrie qu'en laboratoire. Elle permet de préparer des composés aromatiques substitués par une grande variété de groupes fonctionnels suivant le bilan :
avec ArH un composé aromatique et E un groupe électrophile. |
Svante August Arrhenius Svante August Arrhenius (né à Wijk le 19 février 1859 - mort à Stockholm 2 octobre 1927) était un chimiste suédois qui a été pionnier dans de nombreux domaines. Il a reçu le prix Nobel de chimie en 1903. Ses travaux de recherche portèrent sur la conductivité des solutions d'électrolytes. Il bâtit une théorie qui veut que les composés chimiques en solution dans une solution électrolytique (conductrice de charges électriques) sont dissociés en ions, et ce même en l'absence de courant électrique traversant dans la solution, et que les réactions chimiques en solution sont le fait de réactions entre ions. En 1884, il propose aussi une définition des acides et des bases. Enfin en 1889, il propose une loi de variation de la constante de vitesse d'une réaction chimique en fonction de la température. | ||||||||||||
Usine textile et chimique de Saint-Maurice-de-Beynost L'usine textile et chimique Toray de Saint-Maurice-de-Beynost, dans sa forme actuelle usine Toray de Saint-Maurice-de-Beynost, est une usine fondée en 1929 à Saint-Maurice-de-Beynost, dans le département de l'Ain. Elle constituait originellement la seconde usine de la Société lyonnaise de soie artificielle (SLSA), qui devient rapidement la Société lyonnaise de textiles (SLT) puis le Comptoir des textiles artificiels (CTA). En 1959, l'usine est reprise et reconvertie en production chimique (papier film) par La Cellophane. Cette dernière passe par la suite sous le contrôle de Rhône-Poulenc puis de Toray Films Europe, depuis 1996. La construction puis la production effective de l'usine, à la fin des années 1920, a pour conséquence un fort afflux de main-d'œuvre à Saint-Maurice-de-Beynost ; la population quintuple en cinq ans, passant d'environ 300 habitants en 1926 à plus de 1 500 en 1931. La présence de l'usine a eu une forte influence sur la ville, tant au niveau de l'habitat qu'au niveau de la vie sociale. Dans les années 2010, l'usine reste le principal employeur de Saint-Maurice-de-Beynost, avec près de 500 employés. |
Xénon Le xénon est un élément chimique, de symbole Xe et de numéro atomique 54. Le xénon est un gaz rare, inodore et incolore. Dans une lampe à décharge, il émet une belle lumière bleue. Si l'on excepte l'hélium et certains de ses isotopes, le xénon est le plus rare et le plus cher des gaz rares. Étymologiquement, le nom de « xénon » dérive du mot grec xenos, « étranger ». Ce nom vient du fait que le xénon a été découvert sous forme de « gaz inconnu, étranger » dans le krypton lors des identifications successives des gaz rares (argon, krypton, xénon) à la fin du XIXe siècle. Le xénon a été découvert en 1898 par William Ramsay et par Morris William Travers par analyse spectrale de « résidus » de l'air dont on avait éliminé l'oxygène et l'azote. On prépare le xénon par distillation fractionnée de l'air liquide.
| ||||||||||||
Atome L'atome est un composant de la matière. Le mot provient du grec ατομος, atomos, « que l'on ne peut diviser » et certains philosophes de la Grèce antique le définissaient comme le plus petit élément indivisible de la matière. La notion d'atome est maintenant largement utilisée dans les diverses théories permettant d'expliquer les propriétés de la matière. En chimie, l'atome est l'élément de base : les atomes restent indivisibles au cours d'une réaction chimique. Cependant, depuis le début du XXe siècle, des expériences de physique nucléaire ont mis en évidence une structure complexe de son noyau. C'est en transformant cette structure que l'on peut, par exemple, produire l'énergie nucléaire. La majeure partie de la masse de l'atome se trouve concentrée dans le noyau composé de deux sortes de particules semblables, appelées nucléons (les neutrons et les protons). Autour du noyau se trouve « un nuage » de particules identiques : les électrons ; ce nuage électronique est environ 100 000 fois plus grand que le noyau. Le comportement de l'atome et de ses constituants est régi par les lois de la mécanique quantique.
|
William Henry Bragg Sir William Henry Bragg ( à Westward, Cumberland, Angleterre - à Londres) était un physicien et un chimiste britannique. Il a partagé avec son fils, William Lawrence Bragg, le prix Nobel de physique de 1915. Ils découvrirent ensemble la loi de Bragg, qui interprète le processus de la diffraction des radiations sur un cristal. Il a enseigné à l'université d'Adélaïde en Australie (1886-1908), à l'université de Leeds (1909-1915) et à l'université de Londres (1915-1923). À partir de 1923, il a été professeur Fullerien de chimie à la Royal Institution et directeur du laboratoire de recherche Davy-Faraday. Il est devenu Fellow de la Royal Society en 1906 et a aussi été président de cette société de 1935 à 1940. Il est lauréat de la Médaille Rumford en 1916 et de la Médaille Franklin en 1930. À Leeds depuis 1909, Bragg invente le spectromètre et, avec son fils William Lawrence, il fonde une nouvelle discipline : l'analyse par rayons X des structures cristallines. En 1915, le père et le fils sont conjointement récompensés par le prix Nobel de physique « pour leurs travaux d'analyse des structures cristallines à l'aide des rayons X ». Leur somme, X-Rays and Crystal Structure, publiée la même année atteint la cinquième édition dix ans plus tard.
| ||||||||||||
Épitaxie L'épitaxie est une technique de croissance orientée, l'un par rapport à l'autre, de deux cristaux possédant un certain nombre d'éléments de symétrie communs dans leurs réseaux cristallins. On distingue l'homo-épitaxie, qui consiste à faire croître un cristal sur un cristal de nature chimique identique, et l'hétéro-épitaxie, dans laquelle les deux cristaux sont de natures chimiques différentes. L'épitaxie est utilisée pour faire croître des couches minces (quelques nanomètres d'épaisseur). On utilise pour cela une surface parfaitement polie d'un monocristal, le substrat, sur lequel seront déposés d'autres atomes. Le substrat est choisi de façon à avoir des paramètres de maille proches de ceux du cristal que l'on veut obtenir. L'épitaxie en phase liquide utilise le principe de la méthode de Czochralski. Le substrat est mis en contact avec une phase liquide sursaturée en l'élément voulu, qui se précipite et cristallise sur le substrat. Cette technique a l'avantage d'être rapide, mais elle est moins précise que les épitaxies en phase vapeur. L'épitaxie par jet moléculaire s'effectue sous ultra vide. Les éléments à déposer, contenus dans des creusets à haute température, sont évaporés et vont se déposer par transport thermique sur la surface du substrat, plus froide mais de température quand même assez élevée pour permettre le déplacement et le réarrangement des atomes. Les applications de l'épitaxie sont multiples : jonctions semi-conductrices, wafers pour la micro-électronique, Silicon On Insulator...
|
Indices de Miller Les indices de Miller sont une manière de désigner les plans dans un cristal. On utilise des indices similaires pour désigner les directions dans un cristal, les indices de direction. Un cristal est un empilement ordonné d'atomes, d'ions ou de molécules, appelés ci-après « motifs ». La périodicité du motif est exprimée par un réseau constitué de nœuds qui représentent les sommets de la maille. Les arêtes de la maille conventionnelle définissent les vecteurs de la base. Les plans et directions sont qualifiés de « nodaux » (plan nodal, direction nodale) ou mieux encore « réticulaires ». Une direction réticulaire est dite rangée. En métallurgie, on travaille fréquemment avec des cristaux constitués d'un seul type d'atomes ; on parle donc de « plan atomique », de « direction atomique » ou de « rangée d'atomes », mais ce ne sont que des cas particuliers. Le cristal n'est pas isotrope, il n'y a pas de raison que ses propriétés le soient. Les lignes et plans de grande densité vont présenter des propriétés particulières : en optique, la vitesse de propagation de la lumière peut différer selon la direction, provoquant la biréfringence ; plan de clivage : la surface libre est plus stable si elle correspond à un plan de grande densité ; adsorption et réactivité : le nombre de sites d'adsorption, et donc la réactivité chimique, dépend de la densité d'atomes ; dislocations : les glissements se font préférentiellement selon des plans denses, etc.
| ||||||||||||
Polymorphisme En chimie, le polymorphisme est la faculté que possède une substance de cristalliser dans des structures différentes selon les conditions ambiantes. Lorsque la substance est formée d'un seul élément, on lui préfère le terme d'allotropie. Généralement, chaque structure existe dans une région précise de température et de pression : son « champ de stabilité ». Si les paramètres évoluent hors de cette région, elle se transforme en une structure différente par transition de phase, soit par rupture et formation de liaisons chimiques (« transition reconstructive »), soit par simple déformation (« transition displacive »). Un cas particulier de polymorphisme est celui du polytypisme, où les différentes structures sont formées par empilement d'un module (dans la plupart des cas, une couche ou un feuillet) de structure et composition (presque) identique. Les polytypes diffèrent par le mode d'empilement du module le long d'une direction : les deux paramètres de maille dans le plan du module sont communs à tous les polytypes, alors que le troisième diffère. Les polytypes sont distingués par des symboles spécifiques. Les symboles les plus employés sont ceux de Ramsdell, qui associent le nombre de couches dans la période du polytype au symbole correspondant au système cristallin ou réticulaire.
|
Diffractométrie de rayons X La diffractométrie de rayons X est une méthode d'analyse physico-chimique. Elle ne fonctionne que sur la matière cristallisée (minéraux, métaux, céramiques, produits organiques cristallisés), mais pas sur la matière amorphe (liquides, polymères, verres) ; toutefois, la matière amorphe diffuse les rayons X, et elle peut être partiellement cristallisée, la technique peut donc se révéler utile dans ces cas-là. Par contre, elle permet de reconnaître des produits ayant la même composition chimique brute, mais une forme de cristallisation différente, par exemple de distinguer les différentes silices (quartz, cristobalite…), les différents aciers (acier ferritique, austénite…) ou les différentes alumines (corindon/alumine α, γ, δ, θ…). Les rayons X, comme toutes les ondes électromagnétiques, provoquent un déplacement du nuage électronique par rapport au noyau dans les atomes. Ces oscillations induites provoquent une réémission d'ondes électromagnétiques de même fréquence : ce phénomène est appelé diffusion Rayleigh. La longueur d'onde des rayons X étant de l'ordre de grandeur des distances interatomiques (quelques angström), les interférences des rayons diffusés vont être alternativement constructives ou destructives. Selon la direction de l'espace, on va donc avoir un flux important de photons X, ou au contraire très faible ; ces variations selon les directions forment le phénomène de diffraction des rayons X. Ce phénomène a été découvert par Max von Laue et longuement étudié par sir William Henry Bragg et son fils sir William Lawrence Bragg.
| ||||||||||||
Paracétamol Le paracétamol, aussi appelé acétaminophène, est un médicament de la classe des antalgiques antipyrétiques non salicylés. Il est ainsi utilisé contre la fièvre et la douleur. Contrairement aux AINS (comme l'aspirine), il n'a pas d'action anti-inflammatoire. Dans le cadre de douleurs plus fortes, le paracétamol peut être associé à un autre analgésique. Le nom paracétamol vient de la contraction de para-acétyl-amino-phénol. Acétaminophène quant à lui provient de N-acétyl-para-aminophénol. Le paracétamol est le médicament le plus prescrit en France — les trois médicaments les plus prescrits sont tous à base de paracétamol et totalisent plus 260 millions de doses. Il comporte en effet l'avantage de pouvoir être prescrit chez la majorité de la population et d'être dénué d'effets indésirables sérieux lorsqu'il est utilisé aux doses recommandées. En cas de surdosage, le paracétamol est très toxique pour le foie et est chaque année la cause de nombreux décès. |
Sadi Carnot Nicolas Léonard Sadi Carnot (né le et mort le ), usuellement appelé Sadi Carnot, est un physicien et ingénieur français. À l’instar de Copernic, il ne publia qu’un seul livre, les Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance (Paris, 1824), dans lequel il exprima, à l’âge de 27 ans, ce qui s’avéra être le travail de sa vie. Dans cet ouvrage il posa les bases d’une discipline entièrement nouvelle, la thermodynamique. À l’époque d’ailleurs, le terme n’existait pas et c’est William Thomson qui l’inventa au milieu du XIXe siècle. Pourtant c’est bien Sadi Carnot, malgré l’imprécision de certains de ses concepts, son acceptation de la théorie du calorique et de l'axiome de la conservation de la chaleur, qui a créé cette science aussi fondamentale du point de vue théorique que féconde en applications pratiques. Il formula l’exposé raisonné du moteur thermique et les principes de bases selon lesquels toute centrale énergétique, toute automobile, tout moteur à réaction est aujourd’hui conçu. Plus remarquable, cette genèse se fit alors même qu’aucun prédécesseur n’eût encore défini la nature et l’étendue du sujet. En s'appuyant sur des préoccupations purement techniciennes, comme l'amélioration des performances de la machine à vapeur, le cheminement intellectuel de Sadi Carnot est original et annonce des évolutions importantes qui intervinrent à cette époque charnière pour la science moderne.
|






